Современные методы определения глюкозы
Герасименко В.А., к.м.н., Куриляк О.А., к.б.н.
Из архива газеты «Новости А/О Юнимед»
Определение концентрации глюкозы в крови – одно из наиболее часто выполняемых биохимических исследований в КДЛ. Причина исключительной популярности теста связана с высокой заболеваемостью сахарным диабетом. Данный тест выполняется как в условиях стационара, так и в поликлиниках. Больные сахарным диабетом вынуждены исследовать уровень глюкозы в крови в домашних условиях, поскольку без этой информации им трудно скорректировать свою диету, физические нагрузки, применение инсулина и других сахароснижающих препаратов. Исключительная важность теста и большие объемы выполняемых исследований стимулировали разработчиков к созданию различных типов приборов и методов определения концентрации глюкозы в крови.
В настоящее время существует достаточно много методов определения глюкозы. Их можно классифицировать следующим образом.
Методы определения глюкозы в сыворотке крови
— фотометрический по конечной точке
— отражательная фотометрия – сухая химия
Первые два метода крайне неудобны, токсичны и обладают низкой точностью, поэтому мы на них не будем останавливаться.
Глюкозооксидазный метод
Сегодня наибольшее распространение получили методы, основанные на использовании фермента – глюкозооксидазы. В основе метода лежит следующая реакция:
Глюкозооксидаза катализирует перенос двух водородных атомов с первого углеродного атома глюкозы на кислород, растворенный в жидком реагенте. При этом в ходе реакции образуется в эквимолярных количествах перекись водорода. Т.е. концентрация образовавшейся перекиси водорода точно равна определяемой концентрации глюкозы. Следовательно, использование глюкозооксидазной реакции, трансформировало задачу определения концентрации глюкозы в задачу определения концентрации перекиси водорода, которая, как будет показано ниже, значительно проще первой. И здесь есть несколько способов, широко используемых сегодня в лабораторной практике (см. схему).
Среди вышеперечисленных способов регистрации наибольшее распространение получил фотометрический биохимический метод, в котором молекулы перекиси водорода под действием фермента пероксидазы расщепляются с образованием активной формы кислорода – супероксид анион-радикала – О2 — , который в свою очередь окисляет хромоген, что приводит к значительному изменению спектра поглощения хромогена.
На рис. 1 и 2 показаны спектры рабочего раствора до внесения в него стандартного раствора глюкозы и после. Максимум поглощения реакционной смеси – (реактив + глюкоза) находится в области 500 нм. Соответственно, изменение оптической плотности конечной реакции на длине волны 480-520 нм пропорционально концентрации глюкозы, содержащейся в пробе.
Рисунок 1. Спектр рабочего раствора
Рисунок 2. Спектр реакционной смеси (рабочий раствор + глюкоза)
Большая популярность данного метода определения глюкозы объясняется его высокой специфичностью и простотой выполнения. Метод можно реализовать как с применением обычного фотометра (лучше специализированного биохимического фотометра типа Микролаб 540), так и с помощью автоматических биохимических автоанализаторов.
Наряду с методом фотометрирования по конечной точке, несколько лет назад появились наборы, в которых реализован кинетический метод фотометрирования. Суть метода состоит в том, что при определенном соотношении активностей глюкозооксидазы и пероксидазы, скорость образования окрашенного соединения некоторое время после внесения пробы в рабочий раствор будет пропорциональна концентрации глюкозы в пробе. Преимущество такого метода состоит в том, что результат не зависит от наличия в пробе других соединений, поскольку поглощение последних стабильно во времени. Этот метод требует применения кинетического фотометра, например Stat Fax 1904+, Stat Fax 3300, полуавтоматических анализаторов, например Clima 15, или автоматических биохимических анализаторов. Измерение концентрации глюкозы из цельной крови удобно выполнять с помощью приборов, работа которых основана на амперометрическом принципе измерения, при помощи специальных ферментных датчиков. Перекись водорода является крайне нестабильным химическим соединением и она может служить источником заряженных частиц. Именно это и используется в ферментных датчиках мембранного типа или электрохимических элементах портативных глюкометров.
Рисунок 3. Измерительная ячейка
В измерительной ячейке, сконструированной как проточная, находится измерительная камера, с одной стороны ограниченная ферментной мембраной (Рис. 3). На мембрану толщиной около 60 микрон специальным образом сорбирована глюкозооксидаза. С другой стороны мембраны к ней прижимается платиновый электрод.
Проба цельной крови (обычно 20 мкл) разводится в системном буферном растворе (эритроциты разрушаются), после чего подается по магистрали в проточную ячейку. Глюкоза, подвергается окислению под воздействием фермента глюкозооксидазы, находящейся на мембране. Образовавшаяся перекись водорода диффундирует через мембрану и окисляется далее в каталитической реакции под действием платины. Диффузия перекиси водорода на поверхность платины формирует ток, пропорциональный числу молекул Н2О2. Полученный таким образом сигнал обрабатывается прибором в соответствующее значение напряжения. Это измеренное значение пропорционально концентрации глюкозы в пробы.
В качестве примера приборов, использующих вышеописанный метод можно назвать автоматические анализаторы глюкозы Biosen (Германия). Эти приборы удобны для использования не только в стационарах, но и в поликлиниках, где анализ на глюкозу делают преимущественно из капиллярной крови.
Важным этапом в развитии методов клинической лабораторной диагностики стало появление «сухой химии». Естественно, одним из первых приложений этой технологии стала задача определения глюкозы в крови пациента. Первые приборы значительно уступали по точности традицинным лабораторным методам исследований. Однако, со временем, ряду фирм удалось разработать такие диагностические полоски и отражательные фотометры, которые обеспечили весьма высокую точность анализа. Широко популярными во всем мире в настоящее являются глюкометры One Touch и тест-полоски к ним производства компании Life Scan (США), которые удачно сочетают в себе аналитическую точность количественного ферментативного метода со скоростью и простотой «сухой химии».
Глюкометры One Touch предназначены для быстрого и точного измерения уровня глюкозы в цельной крови. Тест-полоска One Touch содержит все необходимые химические компоненты для двухэтапного глюкозооксидазного метода, включая ферменты глюкозооксидазу и пероксидазу, которые сорбированы на уникальную пористую гидрофильную мембрану. Результатом реакции является образование окрашенного комплекса. Интенсивность развившейся окраски регистрируется отражательным минифотометром.
Рисунок 4. Конструкция тест-полоски
В дополнении к этому, мембрана обладает гидрофильными свойствами, благодаря которым капля крови “притягивается” к поверхности тест-полоски при касании.Мембрана тест-полоск One Touch напоминает губку с микроскопическими порами и выполняет тройственную функцию. Она действует: 1) как резервуар, собирая необходимое количество крови, 2) как фильтр, блокируя твердый клеточный материал (эритроциты, лейкоциты и др.), 3) как гладкая оптическая поверхность, на которой измеряется отраженный свет. Последняя функция, в частности, очень важна для работы прибора. Она делает возможным считывать нижнюю часть полоски, тогда как кровь остается на верхней части тест-полоски. Соответственно, нет необходимости стирать (промокать) кровь с поверхности тест-полоски.
В состав приборов One Touch входит два специальных светодиода. Обработка развившейся окраски на тест-полоске идет следующим образом. Как только тест-полоска вставлена в прибор – происходит нулевое считывание. В этот момент на дисплее мы видим: “ЖДАТЬ”. Когда капля крови наносится на тест-полоску, плазма крови моментально сорбируется мембраной, тогда как эритроциты и излишки плазмы остаются на поверхности мембраны. После полного впитывания капли крови немедленно происходит окрашивание. Прибор регистрирует изменение величины отражения и автоматически запускает таймер. Через 45 секунд химическая реакция заканчивается, результат светоотражения обрабатывается. Окрашенный продукт реакции поглощает свет, испускаемый первым светодиодом. Форменные элементы крови и лишняя плазма также поглощают свет, излучаемый диодом. Чтобы скорректировать фоновое отражение, второе считывание производится вторым светодиодом на другой длине волны. Разность сигналов от первого и второго светодиода несет информацию о поглощении света хромогеном. Сигнал, полученный от хромогена для оценки концентрации глюкозы, соотносится со специальной калибровкой. Все приборы One Touch откалиброваны с использованием референтного метода на лабораторном анализаторе глюкозы. С помощью этой процедуры получается стандартная калибровочная кривая. Отметим, что достаточно сложно наладить производство тест-полосок, которые были бы абсолютно одинаковыми химически, в силу очень низкой концентрации реактивов. Для решения этой проблемы используется стандартная калибровочная кривая, состоящая из 16 –ти калибровочных линий. Контроль качества осуществляется сразу после производства тест-полосок, что позволяет определить, какая из калибровочных линий (от 1 до 16) может быть применена для данной тест-полоски. Это так называемый номер кода, который проставляется на упаковке тест-полосок. Эти 16 калибровочных линий также программируются в микропроцессоре прибора. Для получения оптимально точных результатов, номер кода, указанный на упаковке тест-полосок выставляется в приборе при помощи кнопки кода. Таким образом, неправильно установленный код на приборе может являться причиной ошибки измерения.
С момента появления на рынке приборов One Touch прошло большое количество клинических исследований в лабораториях России, Америки и Европы. Одно из таких исследований было проведено Эндокринологическим научным центром РАМН по заказу Российской Ассоциации Медицинской Лабораторной Диагностики. Специалисты Центра провели сравнительный анализ двух методов измерения уровня глюкозы в крови. Результаты, полученные на One Touch, сопоставлялась с данными, полученными на биохимическом анализаторе Spectrum II (Abbott Laboratories, США), реализующем гексокиназный метод определения глюкозы. Было исследовано 190 проб крови от 95 пациентов. Коэффициент корреляции результатов составил 0,98641. Коэффициент вариации в нормальном и патологическом диапазонах на глюкометре One Touch не превысил 2,5%.
Рис. 5. Корреляционная зависимость показаний “One Touch” и «Спектрум-2» (коэффициент корреляции 0,98641)
В заключении следует упомянуть и о недостатках глюкозооксидазного метода. Образующаяся перекись водорода и супероксид анион-радикал могут окислять не только хромоген, но и другие вещества, присутствующие в биологической жидкости: аскорбиновую кислоту, мочевую кислоту, билирубин. При этом, соответственно, доля перекиси, принимающая участие в окислении хромогена, снижается, что приводит к занижению результата по глюкозе. Этот метод линеен, как правило, до 20-30 ммоль/л глюкозы.В официальном отчете Эндокринологического научного центра РАМН сказано: «приборы One Touch обладают высокой точностью и правильностью, а также широким диапазоном измерений. Их можно использовать для диагностики неотложных состояний при диабете, в том числе бригадами “Скорой помощи”, поскольку эти приборы не только надежны, но и быстро дают результаты».
Гексокиназный метод
Регистрация осуществляется при длине волны 340 нм по светопоглощению НАДН. Этот метод является высокоспецифичным и не дает реакции с другими компонентами сыворотки крови. Гексокиназный метод считается референтным для определения глюкозы. Как правило, он линеен до 50 ммоль/л, что позволило его широко рекомендовать для клиник с эндокринологическими отделениями.
Из описанного разнообразия методов определения глюкозы сотрудники КДЛ могут решить для себя, какой способ определения и какой прибор выбрать:
- Методы «мокрой» биохимии, реализованные на автоматических биохимических анализаторах, обеспечат нужды лабораторий с большим потоком анализов.
- Анализаторы глюкозы типа Biosen требуют от оператора минимальных трудозатрат, так как они полностью автоматизированы и достаточно производительны (скорость от 50 до 200 проб в час).
- Для лабораторий с небольшим числом исследований, а также экспресс-лабораторий удобен специализированный биохимический фотометр Микролаб 540.
- Для бригад скрой помощи идеальное решение — глюкометры типа One Touch.
Т.о., задача КДЛ обеспечить не только быстрое, но и высокоточное определение глюкозы, на сегодняшний день вполне решаема.
источник
Методы определение глюкозы в крови
Определение глюкозы в крови – важный этап, чтобы диагностировать сахарный диабет. Для этого необходимо определить состояние углеводного обмена, а в первую очередь содержание глюкозы в крови. В норме ее концентрация лежит в пределах 3, 3-5, 5 ммоль/л. Существует огромное количество методик определения, позволяющих установить глюкозы в крови.
Среди них можно выделить редуктометрические, колориметрические, ферментативные методы определения:
Редуктометрические методы определения. Основаны на способности сахаров, в частности глюкозы, восстанавливать соли тяжелых металлов в щелочной среде. Существуют различные реакции. Одна из них заключается в восстановлении красной кровяной соли в желтую кровяную соль сахарами при условии кипячения и щелочной среде. После этой специфической реакции путем титрования определяется содержание сахаров. Но этот метод не нашел широкого применения в клинике из-за своей трудоемкости и недостаточной точности;
Колорометрические методы определения. Глюкоза способна реагировать с различными соединениями, в результате чего образуются новые вещества определенной окраски (так называемые «цветные реакции»). По степени окраски раствора с помощью специального прибора (фотоколориметра) судят о концентрации глюкозы в крови. Примером такой реакции может послужить метод Самоджи. В основе его лежит реакция восстановление глюкозой гидрата окиси меди, в результате чего образуется молибденовая лазурь.
Ферментативные методы определения концентрации глюкозы в крови наиболее распространены. Выделяют две основные разновидности этих методов: глюкозооксидазный и гексокиназный. На данный момент наиболее распространенными являются глюкозооксидазные методы определения. Они основаны на применении фермента глюкозооксидазы. Этот фермент реагирует с глюкозой, в результате чего образуется перекись водорода. Количество образовавшейся перекиси водорода равно количеству глюкозы в исходной пробе.
Гексокиназный метод определения также является высокоспецифичным и точным, поэтому нашел широкое применение в клинической практике.
57. Аэробный гликолиз. Последовательность реакций до образования пирувата (аэробный гликолиз). Физиологическое значение аэробного гликолиза. Использование глюкозы для синтеза жиров.
Катаболизм глюкозы — основной поставщик энергии для процессов жизнедеятельности организма.
А. Основные пути катаболизма глюкозы
Окисление глюкозы до СО2 и Н2О (аэробный распад). Аэробный распад глюкозы можно выразить суммарным уравнением:
Этот процесс включает несколько стадий (рис. 7-33).
Аэробный гликолиз — процесс окисления глюкозы с образованием двух молекул пирувата;
Общий путь катаболизма, включающий превращение пирувата в ацетил-КоА и его дальнейшее окисление в цитратом цикле;
ЦПЭ на кислород, сопряжённая с реакциями дегидрирования, происходящими в процессе распада глюкозы.
Аэробным гликолизом называют процесс окисления глюкозы до пировиноградной кислоты, протекающий в присутствии кислорода. Все ферменты, катализирующие реакции этого процесса, локализованы в цитозоле клетки.
источник
Моделирование электрохимических методов контроля диабета
Диабет во всем мире является неизлечимым смертельно опасным заболеванием — согласно оценкам Всемирной организации здравоохранения, в мире насчитывается 350 миллионов больных диабетом с годовой летальностью в среднем около 1%. К счастью, достижения современной медицины позволяют диабетикам контролировать уровень глюкозы и ее поступление, что значительно снизило опасность заболевания во многих странах. Большинство больных диабетом должны контролировать уровень сахара в течение дня, и для этого необходим точный метод измерения концентрации глюкозы в крови. В конструкции современных датчиков используется электрохимический метод измерения.
Принцип измерения уровня глюкозы
Контроль диабета, заключающийся во взятии проб крови пациента несколько раз в день, мягко говоря, является инвазивным и неудобным. Продолжающиеся исследования в области электрохимии позволяют создавать все более быстрые и точные методики измерения уровня глюкозы, которые к тому же требуют сбора гораздо меньшего количества крови. Кроме того, с помощью электрохимических методов можно значительно снизить существующие неудобства, связанные с контролем диабета.
«Проверка уровня глюкозы» (David-i98) — собственная работа. Из Википедии.
Электрохимические методы определения уровня глюкозы основаны на обнаружении оксидаз глюкозы (GOx), которые являются биологическими ферментами, окисляющими молекулы глюкозы до глюконовой кислоты. В природе окисление достигается за счет биологического окислителя, например, кофермента FAD + (этот кофермент фактически является катализатором, поскольку он может окислиться обратно до исходного состояния при участии растворенного кислорода).
В электрохимической ячейке такой процесс окисления может протекать на поверхности электрода, при этом электроны попадают в электрическую цепь и создают в ней ток, величина которого может быть измерена. В хорошо спроектированном датчике сила тока будет пропорциональна количеству глюкозы, вступившей в реакцию с ферментом, а значит, и текущей концентрации глюкозы. Данная концепция следует из новаторских исследований американского ученого-медика Леланда Кларка (Leland Clark).
Благодаря специфичности биологического фермента GOx датчик позволяет однозначно определять уровень глюкозы даже в такой смеси, как кровь, содержащей большое количество химических соединений. Наконец, указанная методика была дополнена использованием окислительно-восстановительных медиаторов, которые являются более эффективными реагентами, чем кислород, что способствует более точным измерениям без влияния внешних воздействий.
Зачем моделировать измерение уровня глюкозы программными средствами?
Многие компании в мире производят датчики глюкозы для использования пациентами. В настоящее время процесс разработки миновал стадию проверки концепции. Оптимальные датчики глюкозы, выпускаемые в настоящее время, должны соответствовать новейшим технологическим требованиям с учетом экономических и производственных ограничений.
Хотя принцип работы электрохимического датчика уровня глюкозы весьма прост, его реализация может оказаться сложной. Поскольку датчик должен работать в разных условиях, необходимо продуманное решение, обеспечивающее прямую корреляцию измеряемого тока и концентрации глюкозы в образце. На практике затруднения могут заключаться в изменении концентрации кислорода в крови, а также в присутствии других химических веществ, которые вступают в аналогичные реакции с глюкозой. Помимо этого, возможно изменение температуры датчика под воздействием крови, имеющей температуру тела. Все вышеперечисленные факторы могут оказывать влияние на измеряемый электрический ток в датчике.
Программная среда COMSOL Multiphysics является идеальным средством для решения прикладных двумерных и трехмерных задач электроанализа. Почему? В этой среде можно с легкостью объединить моделирование электрохимических процессов с другими физическими явлениями, например, тепломассообменом. Более того, возможность добавлять определяемые пользователем переменные и уравнения позволяет включать в модель нестандартные или сложные явления типа ферментативной кинетики. Нередко теоретическая модель разрабатывается на основе экспериментальных данных о поведении электрохимической системы. Поэтому от методов численного моделирования требуется высокая гибкость.
Пример датчика, измеряющего уровень глюкозы
Простую модель датчика уровня глюкозы можно найти в Библиотеке моделей COMSOL Multiphysics. Датчик в этом модели использует «встречно-штыревой электрод», в котором анод и катод ячейки датчика разделены на большое количество «штырьков», расположенных параллельно друг другу, что позволяет достичь максимальной плотности тока и чувствительности системы. Поскольку длина «штырьков» обычно значительно превышает их ширину, ею можно пренебречь и упростить задачу до двухмерной элементарной ячейки.
Модель учитывает массообмен глюкозы и окислительно-восстановительных медиаторов за счет диффузии и потоков данных веществ в систему и из нее. Кроме того, катализируемая ферментом реакция между окислительно-восстановительными медиаторами и глюкозой вводится в модель посредством заданного пользователем закона Михаэлиса-Ментен для скорости кинетической реакции (он подробно описан в предыдущей заметке моего коллеги Эяла Спира (Eyal Spier) Enzyme Kinetics, Michaelis-Menten Mechanism (Ферментативная кинетика, механизм Михаэлиса — Ментен)).
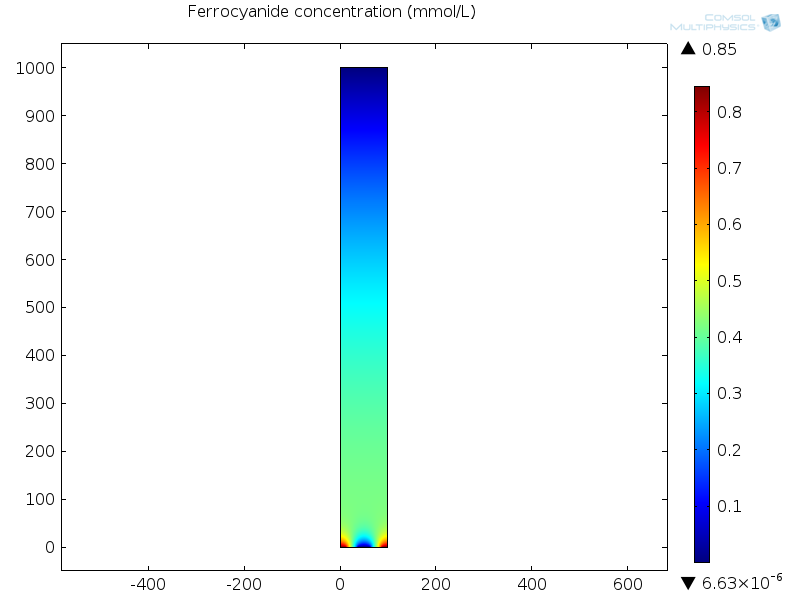
На нижнем рисунке показана концентрация ферроцианидного окислительно-восстановительного медиатора при протекании установившегося тока в датчике.
На аноде (рабочем электроде) снизу в центре данное вещество окисляется с восстановлением другого окислительно-восстановительного соединения, феррицианида, что приводит к уменьшению концентрации. На катоде (противоположный электрод) в нижних левом и правом углах элементарной ячейки ферроцианид регенерируется и диффундирует обратно к рабочему электроду в «окислительно-восстановительном цикле», что обеспечивает высокую плотность тока.
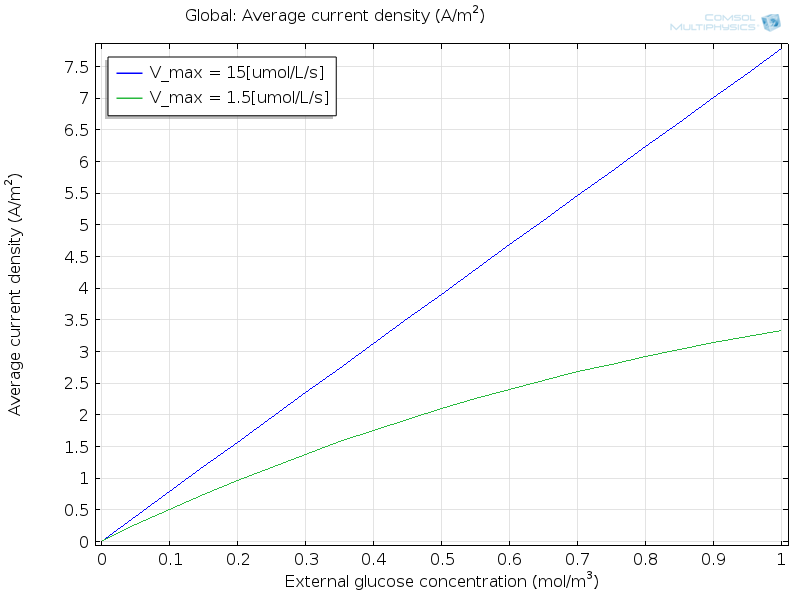
На следующем графике показана зависимость силы тока от концентрации глюкозы для рабочего датчика ( синяя линия), на которой видно, что отклик идеализированного датчика является линейным в исследуемом диапазоне концентраций глюкозы.
Тем не менее, нарушить работу датчика нетрудно ( зеленая линия). Для этого представим, что скорость окисления ферментом самой глюкозы в 10 раз ниже. Это условие можно задать, уменьшив коэффициент ферментативной кинетики v_\mathrm
Совет: ознакомьтесь с моделью Glucose Sensor (Датчик глюкозы) в Галерее моделей.
источник