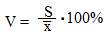Контрольная карта по гемоглобину (округление до целых)
2. Рассчитываем среднее арифметическое по формуле:
Складываем все значения (2368) и делим на 20 (количество измерений). Получаем 118.
3. Рассчитываем среднее квадратичное отклонение по формуле:
Сумма квадратов — 298,8. Делим на 19 (количество измерений минус один). Берем квадратный корень из этого числа. Получаем 4.
4. Рассчитываем коэффициент вариации по формуле:
Делим 4 на 118 и умножаем на 100%. Получаем 3,35.
Среднее арифметическое плюс среднее квадратичное отклонение (122)
Среднее арифметическое минус среднее квадратичное отклонение (114)
Среднее арифметическое плюс удвоенное среднее квадратичное отклонение (126)
Среднее арифметическое минус удвоенное среднее квадратичное отклонение (110)
Среднее арифметическое плюс утроенное среднее квадратичное отклонение (130)
Среднее арифметическое минус утроенное среднее квадратичное отклонение (106)
Вам поручено организовать контроль качества подсчета лейкоцитарной формулы.
1. Как готовятся контрольные мазки для подсчета лейкоцитарной формулы?
2. Какие требования предъявляются к правильному приготовления мазков?
3. Почему не подходит неравномерно (волнообразно) сделанный мазок?
4. Какова методика ведения контроля качества подсчета лейкоцитарной формулы?
1. Контрольные мазки готовятся из капиллярной крови доноров и больных обычным способом не предметных стеклах, выполняя требования к правильному приготовлению мазков, фиксируются и окрашиваются.
2. Хорошо сделанный мазок крови должен отвечать следующим условием:
2.1. Он начинается на 1-1,5 см от узкого края предметного стекла и кончаться в 2-3 см от его другого края.
2.2. Мазок должен быть равномерной толщины, а не волнообразным.
2.3. Мазок должен быть «свободным с края». Другими словами, слой крови не должен достигать длинного края стекла, а между ним к краем должно остаться расстояние в несколько миллиметров.
3. Распределение клеток неудовлетворительно: толстые участки содержат больше лимфоцитов, тонкие — больше моноцитов и сегментоядерных клеток.
4. Контрольные мазки готовятся из капиллярной крови доноров и больных обычным способом не предметных стеклах, выполняя требования к правильному приготовлению мазков, фиксируются и окрашиваются. Затем контрольные мазки многократно просчитываются (не менее 20 раз) по 200 клеток. Из полученных данных статистически рассчитываются критерии определения правильности подсчета мазка путем расчета среднего арифметического.
Моноциты — самые большие, без зернистости
Лимфоциты — самые маленькие
Базофилы — зернистость, почти черные
Эозинофилы — круглые ядра, кирпично-красная зернистость
Нейтофилы — палочкоядерные и сегментоядерные, фиолетовая зеернистость, цельное или сигментированное ядро.
Подсчет клеток крови в мазке, практическая работа
источник
Приложение 2. Методические указания по осуществлению контроля качества гематологических исследований
от 23 апреля 1985 г. N 545
Методические указания
по осуществлению контроля качества гематологических исследований
Одним из важных условий получения достоверных результатов гематологических исследований является внедрение в практику работы клинико-диагностических лабораторий контроля качества гематологических исследований, который представляет собой эффективную систему повышения качества определений.
При осуществлении контроля качества гематологических исследований следует руководствоваться методическими указаниями по осуществлению контроля качества работы клинико-диагностических лабораторий, которые даны в приложении к приказу МЗ СССР N 380 от 16 апреля 1975 года «О состоянии и перспективах развития лабораторной клинико-диагностической службы в стране».
В связи со спецификой гематологических исследований контроля качества их предполагает наличие определенных контрольных средств и материалов, которые не используются в других видах лабораторных исследований.
Внутри- и межлабораторный контроль качества гематологических исследований осуществляется под методическим руководством Всесоюзного научно-методического и контрольного центра по лабораторному делу, а также республиканских, краевых и областных организационно-методических и контрольных центров по лабораторному делу.
Врачи-лаборанты, выделенные для работы по контролю качества лабораторных исследований, внедряют внутри- и межлабораторный контроль качества в практику работы всех клинико-диагностических лабораторий на установленной территории.
II. Внутрилабораторный контроль качества
Внутрилабораторный контроль качества гематологических исследований может осуществляться с помощью методов, использующих специальные контрольные материалы или средства, и ряда методов, не требующих контрольных материалов:
1. Исследование параллельных проб.
2. Исследование случайных проб.
3. Исследование повторных проб.
4. Исследование смешанной пробы.
5. Метод средней нормальных величин (по данным больных).
6. Межлабораторный контроль качества.
Методы, основанные на использовании специальных контрольных материалов. Методы, использующие специальные контрольные материалы, дают возможность проводить контроль правильности и воспроизводимости результатов гематологических исследований. Основным требованием к контрольным материалам является их стабильность во времени. Приготовление контрольных материалов для гематологических исследований связано с трудностями, обусловленными кратким сроком жизнедеятельности клеток крови вне организма и быстрым нарушением их функциональных и физико-химических свойств в течение времени. По этой объективной причине срок годности контрольного материала ограничен.
В настоящее время рекомендуются следующие контрольные материалы:
1. Стандартный раствор гемиглобинцианида (производство ВНР).
3. Раствор гемолизированной крови.
5. Фиксированные клетки крови (суспензия).
6. Клетки синтетических и других материалов, имитирующие клетки крови.
7. Контрольные мазки (окрашенные и неокрашенные, нормальные и патологические).
Контроль воспроизводимости (или сходимости) результатов гематологических исследований осуществляют с помощью контрольных материалов и расчета статистических параметров для оценки качества _ работы: средней арифметической величины (Х), среднеквадратического отклонения (S) и коэффициента вариации (V). Для этого в течение 20 рабочих дней в контрольном материале исследуют выбранный компонент методом, применяемым в данной лаборатории. Если какой-либо из результатов резко отличается от остальных, то его оценивают с помощью критерия Т.
После установления статистических критериев строится карта контроля качества, представляющая собой систему координат, на оси абсцисс которой откладывают дни исследований, а на оси ординат — концентрацию компонента в соответствующих единицах. Через середину оси ординат параллельно абсциссе проводят прямую (обозначает среднюю арифметическую) и вверх и вниз от средней и параллельно ей проводят в соответствии с выбранным _ _ масштабом прямые, которые обозначают контрольные пределы Х + 2S и Х — 2S.
Контрольная карта строится на каждый компонент и на одну серию контрольного материала. При перемене серии контрольного материала нужно провести 20-дневные исследования и построить новую контрольную карту.
Каждый результат, полученный в дальнейшем при исследовании контрольного материала той же серии в последующие дни, отмечается на карте в виде точки и служит для оценки воспроизводимости результатов данного компонента.
Пример 1. Построение контрольной карты для гемоглобина. В течение 20 дней определения содержания гемоглобина в контрольном растворе получены следующие результаты:
При использовании контрольных карт целесообразно пользоваться предупредительными и контрольными критериями, ориентируясь на которые можно обнаружить недостатки в работе лаборатории.
Контроль правильности результатов гематологических исследований осуществляют с помощью контрольных материалов с исследованным содержанием компонентов, расчета статистических параметров и определения достоверности различий между полученным и паспортным значением.
При этом следует сделать 10 параллельных исследований компонента в контрольном материале, рассчитать из полученных результатов среднюю арифметическую величину и сравнить с паспортными данными этого компонента. Если полученный результат укладывается в пределы допустимых отклонений, имеющихся в паспорте контрольного материала, то правильность исследований — удовлетворительная. В противном случае следует оценить достоверность различий результатов с помощью статистических критериев (например, по тесту Стьюдента).
Методы, не требующие контрольных материалов
Исследование параллельных проб позволяет оценить воспроизводимость результатов исследований с помощью образцов крови больных. Для этого отбирают 10 случайных проб и каждую пробу исследуют дважды. Результаты таких дублированных анализов используются для характеристики качества исследований.
Пример 2. Для оценки воспроизводимости результатов подсчета лейкоцитов исследовали параллельно 10 образцов цельной крови с антикоагулянтом. Результаты представлены в табл. 5.
Определение воспроизводимости с помощью
дублированного подсчета количества лейкоцитов (10 проб)
Сначала находят разницу между значениями каждой пары, опуская знаки; затем разницу возводят в квадрат, все складывают и делят на 2n (где n — число пар), так как каждая пара представляет собой индивидуальную переменную и каждый член пары имеет свою собственную вариабельность.
Затем рассчитывают среднеквадратическое отклонение различий и строят контрольную карту для оценки воспроизводимости, аналогичную описанной выше для контрольных проб. Разницу между двумя анализами, сделанными для одной и той же пробы, отмечают каждый день на карте. Контрольные пределы карты — 0 +- 2S (в примере для подсчета лейкоцитов — от -1,157 до +1,157). Результаты, попадающие вне контрольных пределов, с 95% вероятностью покажут существование каких-то нарушений в аналитической системе. В этом случае выявляют возможную причину большого разброса результатов и исследование повторяют более тщательно.
Исследование случайной пробы. Метод этот аналогичен предыдущему методу параллельных проб. Разница заключается в том, что вместо анализа всех проб лаборант выборочно исследует повторно пробы (одну или две пробы). Эти пробы могут также случайно выбираться заведующим лабораторией без ведома лаборанта. Таким путем зав. лабораторией оценивает воспроизводимость результатов, получаемых лаборантами.
Исследование повторных проб. Принцип метода состоит в повторном исследовании нескольких случайно выбранных проб, число которых пропорционально количеству проводимых исследований.
Сравнивая соответствующие пары результатов, получают объективные данные о качестве проведенных исследований. Повторные исследования проб должны проводиться после выполнения анализов текущего дня.
При применении этого метода 5% образцов должны исследоваться повторно.
Метод повторных определений дает возможность оценить качество работы аппаратуры и лаборанта во время исследований. Метод может использоваться в любой лаборатории вне зависимости от количества производимых анализов. Недостатком его является невозможность контроля правильности полученных результатов.
Пробы, выдранные для повторных исследований, могут исследоваться и на следующий день с целью калибровки аппаратуры. Для консервации клеток крови добавляют ЭДТА из расчета 1 — 2 мг на 1 мл крови. Хранить пробы необходимо при 4 град.С.
Исследование смешанной пробы. При оценке воспроизводимости методом дублированных проб получают более близкие значения, чем обычно получают при наличии случайных ошибок. В методе смешанной пробы это исключено. Метод состоит в следующем: из группы образцов случайно выбирают два (А и В); из каждого образца А и В берут равные объемы и смешивают (образец С); исследуют все три образца.
Определение воспроизводимости по смешанным пробам
| Компонент | А | В | С | А + В ——- 2 | Различие* |
| Гемоглобин Для построения контрольной карты по этому методу рекомендуют проводить исследования смешанных проб в течение 40 дней. Метод средней нормальных величин Метод основан на статистическом анализе результатов проб больных. Предполагается, что средняя величина, полученная по данной методике за один день или за определенное время, при большом объеме работы лаборатории (не менее 30 определений) приблизительно постоянна изо дня в день. Если в выполнении анализа вкрадывается систематическая ошибка, то это выразится в сдвиге средней величины результатов. Для построения контрольной карты необходимо в течение 20 дней ежедневно рассчитывать среднюю нормальных величин данного компонента, где _ нормальную область рассматривают в пределах Х +- 2S. Величины, выходящие за эти пределы, отбрасывают. Затем следует рассчитать среднюю и среднеквадратическое отклонение средних за 20 дней и ошибку средних для группы нормальных величин. _ Затем рассчитывают контрольные пределы Х +- 2m. Выбор пределов 2m, а не 3m, делает метод более чувствительным и увеличивает частоту выявления внеконтрольных величин. После построения контрольной карты ежедневно находят среднюю нормальных результатов данного компонента и откладывают на карте. Чем больше результат входит в расчет средней, тем более эффективной становится средняя в определении действительной области. Метод средней нормальных величин дает возможность обнаруживать ошибки, не выявленные другими методами контроля, и является действительным контролем на всех этапах исследования проб больных. Межлабораторный контроль качества Лаборатории, систематически участвующие в межлабораторном контроле качества гематологических исследований, могут использовать результаты контроля для оценки качества своей работы. Особенно ценными являются долгосрочные контрольные опыты. Рассчитанное статически среднеквадратическое отклонение результатов данной лаборатории можно рассматривать как оценку точности в выполнении отдельного теста, а индекс среднеквадратического отклонения (IS) — как отражение способности лаборанта правильно выполнять анализы. Осуществление контроля качества отдельных гематологических параметров Контроль качества исследований содержания гемоглобина. Для контроля качества определения гемоглобина используют стандартные растворы гемиглобинцианида с известным содержанием гемоглобина и специальные контрольные растворы (донорская кровь, гемолизированная кровь и консервированная кровь). Стандартный раствор гемиглобинцианида (производство фирмы «Reanal», ВНР) используют для контроля правильности работы фотометров и построения калибровочной кривой при использовании гемиглобинцианидного метода определения гемоглобина в крови. Определение гемоглобина проводится фотометрическим методом путем определения содержания Hb по калибровочной кривой, выведенной для каждого прибора по серии стандартных растворов гемиглобинцианида с известной концентрацией гемоглобина. Раствор гемолизированной крови. Для контроля воспроизводимости определения гемоглобина применяют растворы гемолизированной крови. Гемолизаты готовят из донорской крови (цитратной), можно с истекшим сроком годности, человеческой или лошадиной. Гемолизаты являются контролем на весь процесс исследования и используются при определении гемоглобина гемиглобинцианидным методом. Основными требованиями к гемолизирующим веществам и растворителям являются следующие: 1) они должны быть бесцветными и прозрачными и не вступать в реакцию с красящими веществами крови; 2) величина разведения должна быть под контролем (рекомендуют 1% раствор крови). Оптически прозрачные растворы готовят при помощи центрифугирования или используя некоторые растворы веществ: 0,1%, 0,25%, 0,4% растворы щелочи, 50% растворы мочевины, раствор сапонина и др. (ГОСТ 4212-76). Раствор гемолизированной крови стабилен не менее года при условии хранения в холодильнике в темной посуде. Для оценки воспроизводимости определений гемоглобина гемолизат _ исследуют в течение 20 дней, из полученных данных рассчитывают Х, S, V, _ контрольные пределы (Х +- 2S) и строят контрольную карту. Коэффициент вариации не должен превышать 5%. Для использования гемолизата в целях контроля правильности следует установить точную концентрацию гемоглобина в данном гемолизате. Ограничения применения гемолизата: 2) трудоемкость приготовления стерильного и гомогенного раствора в условиях лаборатории. Для определения количества гемоглобина пользуются также колориметром простейшего устройства — гемометром Сали. Доводку и коррекцию гемометров Сали производят, определяя одновременно содержание гемоглобина в данной пробе крови спектрофотометрически циангемиглобиновым методом. При этом производят 6 определений: в неразведенной крови и в разведениях 1:2, 1:3, 1:4, 1:5 и 1:6. Это необходимо потому, что результаты, полученные по методу Сали, не подчиняются закону Ламберта-Бера. Полученные данные наносят на систему координат (на листе миллиметровой бумаги), обозначая на ней также результаты, полученные циангемиглобиновым методом. Построенную кривую используют для вычисления результатов при последующих определениях до новой проверки гемометра. Если нет спектрофотометра, то измерение можно провести и на обычном фотометре, но с меньшей точностью. Гемометр Сали является аналитически недостаточно надежным, и из-за своего несовершенства является источником многих ошибок. Контроль качества подсчета клеток крови К контрольным материалам, применяемым для контроля качества подсчета клеток крови, предъявляется ряд дополнительных требований: 1. Материал должен легко приводиться в гомогенное состояние, не агглютинироваться. 2. Физиологические константы и реологические свойства материала, находящегося в растворе жидкости (вязкость, плотность, индекс рефракции, электропроводность), должны соответствовать этим параметрам в крови, а форма и размер частиц — аналогичным клеткам крови. 3. Контрольный материал должен быть химически инертным. Методики приготовления контрольных материалов изложены ниже. Контроль качества подсчета количества эритроцитов Контроль качества определения эритроцитов с помощью контрольных материалов осуществляется по принципу опосредованного контроля методом контрольных карт (табл. 7). В течение 2 дней проводят 20 определений количества эритроцитов в консервированной крови, рассчитывают контрольные пределы и строят контрольную карту. Неудовлетворительная воспроизводимость результатов может быть обусловлена тем, что существуют объективные причины неточностей при определении количества эритроцитов в крови: а) статистическая ошибка, обусловленная подсчетом малого количества клеток в крови; б) распределительная ошибка, обусловленная неравномерным распределением клеток в камере; в) механическая ошибка, обусловленная техническим несовершенством в устройстве счетной камеры. Пример расчета и построения контрольной карты -2S | 4.050.000 |
| 3.925.000 ————————————————————- 3.800.000 ‡‡‡‡‡‡‡‡‡‡‡‡‡‡‡‡‡‡‡‡‡‡‡‡‡‡‡‡‡‡‡‡‡‡‡‡‡‡‡‡‡‡‡‡‡‡‡‡‡‡‡‡‡‡‡‡‡‡‡‡‡ 3.675.000 ————————————————————- 3.550.000 | |
| 1 2 3 4 5 6 7 8 дни исследований |
Контроль качества подсчета лейкоцитарной формулы в мазках крови
Необходимой предпосылкой для правильного учета морфологических особенностей клеток крови является удачно сделанный и хорошо окрашенный мазок крови. Невыполнение одного из этих условий ведет к неправильному распределению клеток крови или плохому выявлению их морфологических особенностей, а вместе с тем и к ошибкам в определении. Хорошо сделанный мазок крови должен отвечать следующим условиям:
1. Мазок должен начинаться на 1 — 1,5 см от узкого края предметного стекла и кончаться в 2 — 3 см от его другого края. Общая длина мазка должна охватывать 0,5 — 0,75 площади стекла.
2. Мазок должен быть равномерной толщины, а не волнообразным. Хороший мазок крови толще всего в начале, постепенно утончается и заканчивается в виде следа, как бы оставленного тонкой щеткой.
3. Мазок должен быть «свободным с края». Другими словами, слой крови не должен достигать длинного края стекла, а между ним и краем должно оставаться расстояние в несколько миллиметров.
Мазки, превышающие 3/4 общей длины предметного стекла, очень толсты. Эритроциты в большей части такого препарата прижаты один к другому или ложатся монетными столбиками. Это мешает правильно исследовать их морфологию. Мазки, короче 1/2 предметного стекла, очень тонки. Лейкоциты отделены друг от друга, сильно деформированы и неправильно распределяются. Отсутствие свободных от крови краев означает, что использованное при приготовлении мазка шлифовальное стекло касалось края предметного стекла. В таких случаях большие клетки перемещаются к края мазка, и это вызывает неправильное распределение клеток. В неравномерном (волнообразном) мазке распределение клеток крайне неудовлетворительно. Толстые участки содержат больше лимфоцитов, тонкие — больше моноцитов и сегментоядерных клеток.
Для доброкачественного исследования морфологии клеток большое значение имеет правильная его фиксация и окраска.
Правильная фиксация мазка придает стойкость форменным элементам крови по отношению к содержащейся в красках воде, которая без фиксации мазка гемолизует эритроциты и изменяет строение лейкоцитов. Фиксация мазка, вызывая коагуляцию белка, прикрепляет препарат к стеклу.
В качестве фиксаторов предложены: метиловый спирт, этиловый спирт, смесь Никифорова, состоящая из равных частей этилового спирта и серного эфира. Лучшим фиксатором является метиловый спирт.
Недостаточная фиксация мазка дает слабую окраску нейтрофильной зернистости лейкоцитов и ведет к некачественной окраске клеток.
Качественная окраска мазка позволяет правильно дифференцировать клетки крови и их структуру при микроскопическом исследовании.
При применении любой методики окрашивания мазка крови важно точно соблюдать методические правила приготовления растворов и временные промежутки в течение процесса окрашивания. При приготовлении растворов, необходимо учитывать рН воды; она должна быть нейтральной.
Партии красителя, существующие в продаже, имеют различную интенсивность окраски. Это обязывает опытным путем установить оптимальные концентрацию (разведение) и время окрашивания для каждого флакона красителя, которые устанавливаются путем окрашивания серии препаратов растворами с различной концентрацией красителя, меняя длительность его воздействия.
Для контроля качества подсчета лейкоцитарной формулы в мазках крови используют контрольные мазки. Контрольные мазки готовятся из капиллярной крови доноров и больных обычным способом на предметных стеклах, выполняя требования к правильному приготовлению мазков, фиксируются и окрашиваются. Затем контрольные мазки многократно просчитываются (не менее 20 раз) по 200 клеток квалифицированными специалистами (не менее 5 человек). Из полученных данных статистически рассчитываются критерии _ определения правильности подсчета мазка путем расчета Х и S. Для удлинения срока хранения мазка используют свойства клея БФ-6 образовывать тонкую прозрачную пленку, герметически приклеивающуюся к поверхности мазка и стекла и предохраняющую мазок от воздействия окружающей среды.
Кроме специально приготовленных мазков в качестве контрольных образцов используют мазки, исследованные в данной лаборатории и оказавшиеся наиболее трудными для диагностики. Контрольные образцы, нормальные и патологические, регулярно вводятся в поток клинических образцов, и с их помощью проверяют качество работы каждого сотрудника лаборатории. Подсчет лейкоцитарной формулы считается правильным, если _ результаты подсчета клеток входят в рассчитанные контрольные границы Х +2S для каждого вида клеток крови.
III. Межлабораторный контроль качества гематологических исследований
Межлабораторный контроль качества гематологических исследований осуществляется в соответствии с методическими указаниями (см. приложение 1 к настоящему приказу МЗ СССР).
Межлабораторный контроль качества гематологических исследований осуществляется периодически, не реже одного раза в квартал, под методическим руководством контрольного центра по лабораторному делу республики, края, области.
При межлабораторных экспериментах по контролю качества гематологических исследований можно рекомендовать для контроля следующие параметры:
1) содержание гемоглобина (в нормальной и патологической области концентрации);
4) скорость оседания эритроцитов;
7) подсчет лейкоцитарной формулы.
В качестве контрольного материала при осуществлении межлабораторного контроля качества используют консервированную кровь, фиксированные клетки крови, контрольные образцы мазков крови. Методы их получения и приготовления изложены ниже.
Контрольные пробы рассылают в пузырьках или в запаянных ампулах. Количество материала рассчитывают, исходя из числа участвующих лабораторий и количества контролируемых показателей. Для удобства пересылки мазков по почте мазки готовят на рентгеновской пленке и пересылают в конвертах.
Контрольные мазки, фиксированные, но неокрашенные, рассылают с целью выяснения правильности окраски мазков крови. Окраска мазков производится в лаборатории-участнице межлабораторного эксперимента, а результаты подсчета лейкоцитарной формулы возвращаются в контрольный центр, где оцениваются правильность окраски и подсчета лейкоцитарной формулы.
Оценка результатов участников контроля. После получения результатов контрольных исследований контрольный центр определяет критерии оценки качества исследований и проводит статистическую обработку результатов. Критериями для оценки результатов участников могут служить: статистически обработанные усредненные данные всех участников контрольного эксперимента (при достаточно большом количестве лабораторий — не менее 20).
Количественные параметры (концентрация гемоглобина, величина гематокрита, клетки крови) оценивают статистически. Если результат _ _ укладывается в Х +- 1,5S, то его считают хорошим, в Х +- 2S — _ удовлетворительным и > Х +- 2S — неудовлетворительным.
Для оценки результатов исследования мазков крови пользуются двумя критериями — удовлетворительно и неудовлетворительно. Удовлетворительно следует оценивать правильно подсчитанную лейкоцитарную формулу с описанием измененной морфологии эритроцитов и лейкоцитов.
При исследовании контрольных мазков патологической крови лаборатория должна дать краткое заключение о предполагаемой патологии.
Неудовлетворительным считают исследование при отсутствии описания измененной морфологии эритроцитов, а также если не обнаружен какой-либо вид патологии (палочкоядерный сдвиг, эозинофилия, лимфоцитарная и моноцитарная реакция, сдвиг формулы до миелобластов, наличие бластных форм, плазматических клеток и т.д.).
Методика приготовления контрольных материалов
Контрольный материал, приготовленный по одной из описанных ниже методик, обрабатывают и исследуют так же, как и пробы больных. Ошибки самого исследования нужно отличать от ошибок, присущих материалу. Для этого нужно быть в полной уверенности, что в результате хранения не произошло таких изменений материала, которые превысили бы воспроизводимость самого метода исследования.
Внутрилабораторный контроль воспроизводимости результатов гематологических параметров осуществляется по общепринятому методу контрольных проб с построением контрольных карт и последующим ежедневным откладыванием значений контрольных проб.
Для определения истинных значений числа клеток в контрольных материалах используют прямой подсчет разведенного материала в камере для подсчета клеток. Этот метод является достаточно точным при применении проверенных (откалиброванных) камер и проведении довольно большого числа подсчетов для снижения случайных ошибок исследования. Средняя арифметическая из числа подсчетов является критерием для оценки правильности исследований.
1. Контрольные материалы для исследований гемоглобина
Приготовление раствора гемолизата. Для приготовления гемолизата используют:
1) консервированную человеческую кровь (цитратную), можно с истекшим сроком годности;
2) консервированную лошадиную кровь;
3) донорскую человеческую кровь, свежую, собранную в сосуд с 0,6 моль/л раствором лимоннокислого натрия из расчета 1:5.
200 мл полученной цитратной крови центифугируют при 3.000 об/мин в течение 30 мин. Плазму сливают. К эритроцитам добавляют 100 мл стерильной дистиллированной воды и тщательно перемешивают на магнитной мешалке в течение 30 мин. Раствор помещают в холодильник при -20 град.С на 24 часа. На следующий день раствор размораживают и вновь тщательно перемешивают в течение 30 мин.
Затем раствор фильтруют в асептических условиях через стеклянный фильтр millipore (соответствует N 4 — с величиной пор 4 — 10 мкм — отечественного производства) и разливают в стерильные бутылочки по 1 мл. Хранят раствор в холодильнике, оптимальная температура -20 град.С. Стабилен в течение года.
Гемолизат используется для контроля воспроизводимости результатов определения гемоглобина с помощью контрольных карт. При наличии в лаборатории контрольного материала с известным содержанием гемоглобина в растворе гемолизата можно определить точную величину гемоглобина и использовать для контроля правильности.
При определении концентрации гемоглобина в крови необходимо избегать следующих ошибок.
а) использование неточно откалиброванных пипеток (0,02 мл),
б) неточное заполнение капилляра кровью,
в) неточное пипетирование физиологического раствора и крови.
а) использование неточно откалиброванной пипетки (5,0 мл),
б) недостаточно чистая посуда (следы крови),
в) недостаточное прополаскивание реактивом,
г) неточное пипетирование реактивов,
д) использование старых, неправильно приготовленных реактивов.
а) использование неоткалиброванного прибора,
б) использование грязных или непарных кювет,
в) мутность растворенной пробы.
II. Контрольные материалы для подсчета числа эритроцитов
1. Консервированная кровь. Консервированную кровь сохраняют вне организма в течение длительного срока с поддержанием всех биологических и функциональных свойств. Консервированная кровь должна сохраняться без явлений деструкции эритроцитов.
Для приготовления консервированной крови в качестве стабилизаторов используются антикоагулянты, и на основе этих веществ предложены следующие консервирующие растворы (рН растворов доводят до требуемого значения 0,1 моль/л NaOH):
I. 1) Натрий лимоннокислый (цитрат натрия) — 2 г ч, чда.
2) D (+) — Глюкоза — 3,0 г, безводная, ч, чда.
3) Левомицетин — 0,075 г фарм.
4) Бидистиллированная вода — до 100 мл.
рН раствора доводится до 4,5 — 5,1. Консервированная кровь готовится путем добавления к крови консервирующего раствора в отношении 4:1.
II. 1) Лимонная кислота — 1,0 г, чда, хч.
2) D (+) — Глюкоза — 3,0 г, безводная, ч, чда.
3) Натрий фосфорнокислый трехзамещенный — 0,75 г, ч, чда.
4) Бидистиллированная вода — до 100 мл.
рН раствора доводят до 5,7 (5,5 — 6,0). Консервированную кровь готовят путем добавления к крови консервирующего раствора в отношении 4:1.
III. 1) Глюкоза — 25 г, безводная, ч, чда.
2) Натрий лимоннокислый — 22 г, чда.
3) Лимонная кислота — 8 г, ч, чда, хч.
4) Бидистиллированная вода — до 1000 мл.
рН раствора доводится до 6,4. Консервированная кровь готовится путем добавления к крови консервирующего раствора в отношении 3:1.
IV. 1) D (+) — Глюкоза — 2,0 г, безводная, ч, чда.
2) Натрий лимоннокислый — 300,0 г., ч, чда.
3) Натрий фосфорнокислый безводный однозамещенный — 0,15 г, ч, чда.
4) Бидистиллированная вода — до 1000 мл.
рН раствора доводится до 6,9. Консервированная кровь готовится путем добавления к крови консервирующего раствора в отношении 2:1.
V. 1) D (+) — Глюкоза — 20,5 г, безводная, ч, чда.
2) Натрий лимоннокислый — 8,0 г, ч, чда.
3) Лимонная кислота — 0,55 г, ч, чда, хч.
4) Натрий хлористый — 4,2 г, ч, чда, хч.
5. Бидистиллированная вода — до 1000 мл.
рН раствора доводится до 6,1. Консервированная кровь готовится путем добавления к крови консервирующего раствора в отношении 4:1.
В консервированных растворах эритроциты сохраняют свои функциональные и биологические свойства в течение нескольких дней при 20 град.С, а в условиях холодильника — до 20 — 30 дней.
Суспензия фиксированных эритроцитов. При фиксации эритроцитов происходят физико-химические изменения в мембране эритроцитов, что предохраняет клетки от лизиса. В качестве фиксирующего материала предложены формальдегид, танин, глутаральдегид, ледяная уксусная кислота.
Наибольшее распространение получила методика фиксации эритроцитов глутаральдегидом. После фиксации размер клеток изменяется в течение первых 3 — 4 дней, затем остается стабильным от нескольких месяцев до нескольких лет.
Методика приготовления. Кровь собирают в сосуд с антикоагулянтом ЭДТА (5 мг сухого ЭДТА на 1 мл крови). Затем трижды промывают изоосмотическим фосфатным буфером. Для этого к собранной крови добавляют раствор буфера в 2 раза больше объема крови и полученную суспензию центрифугируют в течение 10 мин при 3000 об/мин. Промытые эритроциты фиксируют 0,25% раствором глутаральдегида в фосфатном буфере, который постепенно добавляют к эритроцитам в отношении 1:10 (кровь: фиксирующий раствор). Фиксация производится при комнатной температуре в течение часа. Фиксированные эритроциты трижды промывают дистиллированной водой и доводят до окончательного объема водой или 12,5% раствором глицина. Затем добавляют 3 мл 1% раствора азида натрия. Тщательно перемешивают на магнитной мешалке в течение 30 минут и разливают в стерильные стеклянные пузырьки по 2 — 5 мл. Хранение проводят при 4 град.С. Перед использованием материал перемешивают на магнитной мешалке в течение 10 мин.
Приготовленную суспензию хранят в темных склянках в холодильнике при 4 град.С. Срок хранения — от 6 месяцев до 1 года. Суспензию используют для контроля качества подсчета эритроцитов автоматическим и камерным методами.
Приготовление изоосмотического фосфатного буфера 154 ммоль/л, рН 7,4:
0,246 г однозамещенного фосфорнокислого калия и 3,187 г двузамещенного фосфорнокислого калия трехводного растворяют дистиллированной водой в мерной колбе на 100 мл.
Ограничения применения консервированной крови и фиксированных клеток крови
2. Фиксированные эритроциты обладают большей вязкостью по сравнению с кровью (прилипают к стенкам и не переходят в состояние суспензии).
3. При фиксировании клеток изменяется их электрический заряд, что влияет на правильность результатов при автоматическом подсчете клеток.
4. Фиксированные клетки более регидны, что затрудняет их прохождение через отверстия анализатора и меняет амплитуды пульсовой волны (при автоматическом подсчете).
5. В первые 3 — 5 дней происходит уменьшение объема фиксированных эритроцитов, затем их размеры остаются стабильными в течение 6-ти месяцев.
6. Дефицитность реактивов (глутаральдегида и азида натрия).
При подсчете количества клеток крови следует избегать следующих ошибок.
а) использование неточно откалиброванных пипеток;
б) неточное пипетирование и разведение крови,
в) недостаточно быстрый забор крови и размешивание ее с реактивом для разведения.
а) неточное пипетирование реактива для разведения,
б) использование грязной посуды и пипеток,
в) использование неточно откалиброванных пипеток,
г) использование некачественного реактива для разведения, вызывающего гемолиз эритроцитов.
а) несоблюдение правил подготовки счетной камеры,
б) несоблюдение временных промежутков при подсчете количества эритроцитов в камере, необходимых для оседания клеток на сетку,
в) нетщательное перемешивание крови перед заполнением камеры,
г) подсчет клеток в недостаточном количестве квадратов и несоблюдение правил подсчета,
д) использование неоткалиброванного прибора при автоматическом подсчете клеток.
Метод сохранения мазков для многократного микроскопирования
К 0,5 мл клея БФ-6 прибавляют 3 мл абсолютного спирта, 3 мл бутилового спирта и тщательно перемешивают до получения прозрачной жидкости с желтоватым оттенком. Хранят в склянке с хорошо притертой пробкой.
На предметное стекло с мазком наносят пипеткой большую каплю пленкообразующей смеси и, покачивая стекло, дают ей равномерно растечься по его поверхности. Избыток смеси с края стекла удаляют и препарат кладут на горизонтальную поверхность для высушивания. При комнатной температуре пленка высыхает за 15 — 20 мин. Для ускорения сушки мазок можно поместить в термостат при 60 град.С.
Откройте актуальную версию документа прямо сейчас или получите полный доступ к системе ГАРАНТ на 3 дня бесплатно!
Если вы являетесь пользователем интернет-версии системы ГАРАНТ, вы можете открыть этот документ прямо сейчас или запросить по Горячей линии в системе.
источник