Распад гемоглобина в тканях (образование желчных пигментов)
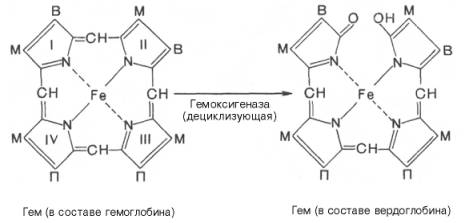
Продолжительность жизни эритроцитов составляет 120 дней, затем они разрушаются и освобождается гемоглобин. Главными органами, в которых происходят разрушение эритроцитов и распад гемоглобина, являются печень, селезенка и костный мозг, хотя в принципе оба процесса могут происходить и в клетках других органов. Распад гемоглобина в печени начинается с разрыва α-метиновой связи между I и II кольцами порфиринового кольца. Этот процесс катализируется НАДФ-содержащей ок-сидазой и приводит к образованию зеленого пигмента вердоглобина (холеглобина):
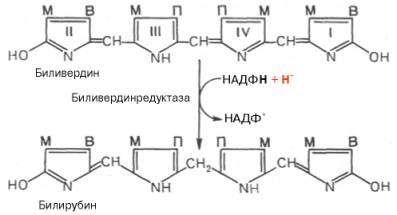
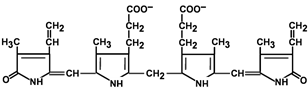
В приведенных структурных формулах здесь и далее в желчных пигментах М – метильная СН3-группа, В – (—СН=СН2) – винильная группа и П – (—СН2—СН2—СООН) – остаток пропионовой кислоты.
Как видно из приведенных формул, в молекуле вердоглобина еще сохраняются атом железа и белковый компонент. Имеются экспериментальные доказательства, что в этом окислительном превращении гемоглобина принимают участие витамин С, ионы Fe 2+ и другие кофакторы. Дальнейший распад вердоглобина, вероятнее всего, происходит спонтанно с освобождением железа, белка-глобина и образованием одного из желчных пигментов – биливердина. Спонтанный распад сопровождается перераспределением двойных связей и атомов водорода в пиррольных кольцах и метиновых мостиках. Образовавшийся биливердин ферментативным путем восстанавливается в печени в билирубин, являющийся основным желчным пигментом у человека и плотоядных животных:
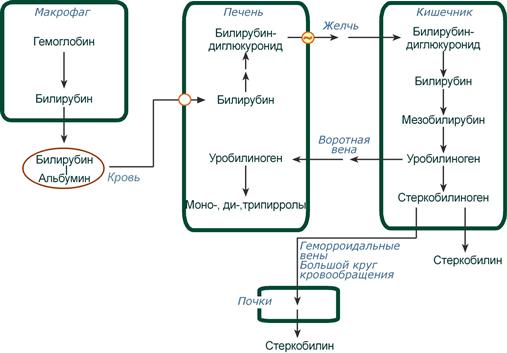
Основное место образования билирубина – печень, селезенка и, по-видимому, эритроциты (при распаде их иногда разрывается одна из метиновых связей в протопорфирине). Образовавшийся во всех этих клетках билирубин поступает в печень, откуда вместе с желчью попадает в желчный пузырь (см. главу 16). Билирубин, образовавшийся в клетках системы макрофагов, называется свободным, или непрямым, билирубином, поскольку вследствие плохой растворимости в воде он легко адсорбируется на белках плазмы крови и для его определения в крови необходимо предварительное осаждение белков спиртом. После этого билирубин вступает во взаимодействие с диазореактивом Эрлиха.
В крови взрослого здорового человека содержится относительно постоянное количество общего билирубина – от 4 до 26 мкмоль/л, в среднем 15 мкмоль/л. Около 75% этого количества приходится на долю непрямого билирубина. Повышение его концентрации в крови до 35 мкмоль/л приводит к желтухе. Более высокий уровень билирубина в крови вызывает явления тяжелого отравления. Непрямой билирубин, поступая с током крови в печень, подвергается обезвреживанию путем связывания с глюку-роновой кислотой. В этом процессе принимают участие особый фермент УДФ-глюкуронилтрансфераза и УДФ-глюкуроновая кислота, являющаяся донором глюкуроновой кислоты. При этом к билирубину присоединяются 2 остатка глюкуроновой кислоты с образованием сравнительно индифферентного комплекса – билирубин-диглюкуронида, хорошо растворимого в воде и дающего прямую реакцию с диазореактивом. В желчи всегда присутствует прямой билирубин. В крови количество прямого и непрямого билирубина, а также соотношение между ними резко меняются при поражениях печени, селезенки, костного мозга, болезнях крови и т.д., поэтому определение содержания обеих форм билирубина в крови имеет существенное значение при дифференциальной диагностике различных форм желтухи. При желчнокаменной болезни в составе желчных камней наряду с основным их компонентом – холестерином всегда обнаруживается непрямой билирубин. Вследствие плохой растворимости в воде он выпадает в осадок в желчном пузыре в виде билирубината кальция, участвующего в формировании камней.
Дальнейшая судьба желчных пигментов, точнее билирубина, связана с их превращениями в кишечнике под действием бактерий. Сначала глю-куроновая кислота отщепляется от комплекса с билирубином и освободившийся билирубин подвергается восстановлению в стеркобилиноген, который выводится из кишечника. В сутки человек выделяет около 300 мг стеркобилиногена. Последний легко окисляется под действием света и воздуха в стеркобилин. Механизм бактериальных превращений билирубина до стеркобилина до конца еще не расшифрован. Имеются данные, что промежуточными продуктами восстановления являются последовательно мезобилирубин и мезобилиноген (уробилиноген). После всасывания небольшая часть мезобилиногена поступает через воротную вену в печень, где подвергается разрушению с образованием моно- и дипиррольных соединений. Кроме того, очень небольшая часть стеркобилиногена после всасывания через систему геморроидальных вен попадает в большой круг кровообращения, минуя печень, и в таком виде выводится с мочой. Однако называть его уробилиногеном не совсем точно (см. главу 18). Суточное содержание стеркобилиногена в моче составляет около 4 мг, и, пожалуй, именно стеркобилиноген является нормальной органической составной частью мочи. Если с мочой выделяется повышенное содержание уробилиногена (точнее, мезобилиногена), то это является свидетельством недостаточности функции печени, например, при печеночной или гемолитической желтухе, когда печень частично теряет способность извлекать этот пигмент из крови воротной вены. Химически уробилиноген (мезо-билиноген) неидентичен стеркобилиногену (уробилиногену) мочи. Исчезновение стеркобилиногена (уробилиногена) из мочи при наличии билирубина и биливердина является свидетельством полного прекращения поступления желчи в кишечник. Такое состояние часто наблюдается при закупорке протока желчного пузыря (желчнокаменная болезнь) или общего желчного протока (желчнокаменная болезнь, раковые поражения поджелудочной железы и др.).
Таким образом, количественный и качественный анализ желчных пигментов в моче может представлять большой клинический интерес.
источник
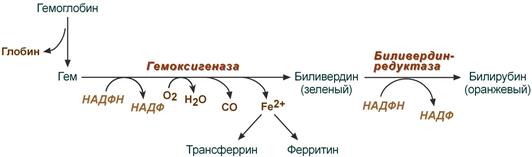
Распад гема — многостадийный процесс
За сутки у человека распадается около 9 г гемопротеинов, в основном это гемоглобин эритроцитов.
Эритроциты в норме живут 90-120 дней, после чего лизируются в клетках ретикулоэндотелиальной системы – макрофагах селезенки (главным образом), купферовских клетках печени и макрофагах костного мозга. При разрушении эритроцитов в кровеносном русле высвобождаемый гемоглобин образует комплекс с белком-переносчиком гаптоглобином (фракция α2-глобулинов крови) и также переносится в клетки РЭС селезенки, печени и костного мозга.
Синтез билирубина
В клетках РЭС гем в составе гемоглобина окисляется молекулярным кислородом. В реакциях последовательно происходит разрыв метинового мостика между 1-м и 2-м пиррольными кольцами гема с их восстановлением, отщеплением железа и белковой части и образованием оранжевого пигмента билирубина. Высвобождаемое железо может либо запасаться в клетке в комплексе с ферритином, либо выделяться наружу и связываться с трансферрином.
Реакции распада гемоглобина и образования билирубина
Билирубин – токсичное, жирорастворимое вещество, способное разобщать окислительное фосфорилирование в клетках. Особенно чувствительны к нему клетки нервной ткани.
Строение билирубина
Выведение билирубина
Из клеток ретикуло-эндотелиальной системы билирубин попадает в кровь. Здесь он находится в комплексе с альбумином плазмы, в гораздо меньшем количестве – в комплексах с металлами, аминокислотами, пептидами и другими малыми молекулами. Образование таких комплексов не позволяет выделяться билирубину с мочой. Билирубин в комплексе с альбумином называется свободный (неконъюгированный) или непрямой билирубин.
Этапы метаболизма билирубина в организме
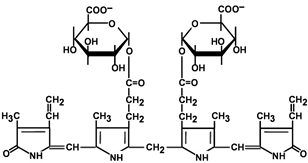
Из сосудистого русла в гепатоциты билирубин попадает с помощью белка-переносчика (транспортный белок органических анионов) или по механизму флип-флоп. Далее при участии цитозольного связывающего белка лигандина (Y-протеин) билирубин транспортируется в ЭПР, где протекает реакция связывания билирубина с УДФ-глюкуроновой кислотой, при этом образуются моно — и диглюкурониды . Кроме глюкуроновой кислоты, в реакцию конъюгации могут вступать сульфаты, фосфаты, глюкозиды.
Билирубин-глюкуронид получил название связанный (конъюгированный) или прямой билирубин.
Реакции синтеза билирубин-диглюкуронида
Строение билирубин-диглюкуронида
(прямой билирубин)
После образования билирубин-глюкурониды АТФ-зависимым переносчиком секретируются в желчные протоки и далее в кишечник, где при участии бактериальной β-глюкуронидазы превращаются в свободный билирубин. Одновременно, даже в норме (особенно у взрослых), некоторое количество билирубин-глюкуронидов может попадать из желчи в кровь по межклеточным щелям.
Таким образом, в плазме крови обычно присутствуют две формы билирубина: свободный (непрямой) , попадающий сюда из клеток РЭС (80% и более всего количества), и связанный (прямой) , попадающий из желчных протоков (в норме не более 20%).
Термины «связанный«, «конъюгированный«, «свободный«, «несвязанный» отражают взаимодействие билирубина и глюкуроновой кислоты (но не билирубина и альбумина!).
Термины «прямой» и «непрямой» введены, исходя из возможности химической реакции билирубина с диазореактивом Эрлиха. Связанный билирубин реагирует с реактивом напрямую , без добавления дополнительных реагентов, т.к. является водорастворимым. Несвязанный (жирорастворимый) билирубин требует добавочных реактивов, реагирует не прямо.
Превращение в кишечнике
В кишечнике билирубин подвергается восстановлению под действием микрофлоры до мезобилирубина и мезобилиногена ( уробилиногена ). Часть уробилиногена всасывается и с кровью портальной вены попадает в печень, где либо распадается до моно-, ди- и трипирролов, либо окисляется до билирубина и снова экскретируется. При этом при здоровой печени в общий круг кровообращения и в мочу мезобилирубин и уробилиноген не попадают, а полностью задерживаются гепатоцитами.
Оставшаяся в кишечнике часть пигментов ферментами бактериальной флоры толстого кишечника восстанавливается до стеркобилиногена . Далее
- малая часть стеркобилиногена может всасываться и катаболизировать в печени, подобно уробилиногену,
- незначительное количество стеркобилиногена через геморроидальные вены попадает в большой круг кровообращения, отсюда в почки и в мочу. После окисления на воздухе из стеркобилиногена образуется стеркобилин мочи,
- однако основное количество стеркобилиногена достигает нижних отделов толстого кишечника и выделяется. В прямой кишке и на воздухе стеркобилиноген окисляется в стеркобилин , окрашивая кал,
- аналогично уробилиноген, появляющийся в моче при патологии печени, окисляется в уробилин .
источник
Распад гемоглобина в клетках РЭС.
1.Основные гормоны щитовидной ж-зы: трийодтиронин (Т3) и тетрайодтиронин (Т4, тироксин), которые являются производными тирозина и кальцитонин (полипептид, участвующий в регуляции уровня кальция). Образуются Т3 и Т4в тироцитах фолликулов, кальцитонин – в С-клетках.
1 – йод всасывается в тиреоцит с помощь I2-насоса, активируемого К+/Na+-АТФ-азой
2 – В апикальной части клетки йод окисляется тиреопероксидазой = > образуются ионы йода, которые включаются в молекулу тиреоглобулина.
3 – при йодирования тиреоглобулина образуются монойодтирозин, дийодтирозин, Т3, Т4.
4 – капли коллоида, содержащие йодированный тиреоглобулин, путем эндоцитоза поступают в тиреоцит.
5 – гидролиз тиреоглобулина фементами лизосом и высвобождение гормонов в кровь.
— Т3 связывается с ядерными рецепт., ядерные рец. экспрессируют (активируют) гены: К+/Na+-АТФ-азы, дыхательных ферментов, белков-разобщителей окислительного фосфорилирования, СОД (антиоксидантная защита), гормона роста, повышает число рецепторов к ЛПНП (защита от склероза). Гены, ингибируемые Т3: ген тиролиберина, ТТГ, ЛГ
— цитоплазматические рец.: транспорт АК в клетки, участие в ангиогенезе
— митохондриальные рец.: транспорт АДФ в митохондрии и ↑ синтеза АТФ.
↑ основной обмен (↑ потребление О2 клетками, кроме мозга, РЭС, гонад), ↑ теплопродукция на холоде, ↑ эффект катехоламинов на сердце, ↑ мышечное сокращение и моторику жкт, ↑ резорбцию кости (кальцитонин), стимулируют рост и клеточную дифференцировку, необходимы для нормального развития ЦНС плода.
Гипотиреоз у взрослых – микседема. Причины: нарушение синтеза Т3 и Т4 в ЩЖ и на периферии (аутоиммунный тиреоидит – наиболее частая причина ), нарушение функции гипофиза и/или гипоталамуса. Клиническая картина: брадикардия, вялость, сонливость, сухость кожи, непереносимость холода, раннее старение.
Гипертиреоз. ↑ ↑ основного обмена, ↑ процессов катаболизма (похудание), частичное разобщение окислительного фосфорилирования. Умеренная гипергликемия. Клинич. картина: тахикардия, дистрофия миокарда, диарея, субфибрильная температура.
2.Физиологическая желтуха новорожденных (ФЖН)
Общий билирубин: до 220 мкмоль/л у доношенных и до 170 мкмоль/л у недоношенных; более 240 мкмоль/л – ядерная желтуха, энцефалопатия.
— HbF = > HbA? низкая активность УДФ-ГТ
— избыток эстрогенов, более высокое их сродство к УДФ-ГТ
— функциональная недостаточность гепатоцитов = > ↓количество УДФ-ГТ = > индукторы ее синтеза = >снотворные (фенобарбитал), гепатопротекторы (зиксорин)
Фототерапия: билирубин = > «люмирубин»
3. Альбумин – главный белок человеческой плазмы. Молекулярная масса 66 кДа, молекула ассиметрична, имеет множество ионизированных групп на поверхности ( в результате высокая растворимость). Функции: 1) транспортная 2) обеспечивает 75-80% осмотического давления 3) белковый резерв организма. Содержание – 40г/л
Глобулины – менее растворимы в воде, имеют более высокую молекулярную массу, различают несколько фракций, отличающихся по подвижности в электрическом поле. Функции: определяют иммунные свойства организма;
определяют свертываемость крови; участвуют в транспорте железа и в других процессах. Содержание: α1 – 0,2-0,4г/л; α2 – 2-3 г/л; β – 1,6-2,8 г/л;
Фибриноген — белок, вырабатываемый в печени и превращающийся в нерастворимый фибрин — основу сгустка при свертывании крови. Фибрин впоследствии образует тромб, завершая процесс свертывания крови. Содержание: 2 — 4 г/л
4.Биол. значение вит. С: 1) кофактор в синтезе коллагена (гидроксилирование пролина и лизина) 2) гидроксилирование триптофана в 5-гидрокситриптофан (при синтезе серотонина) 3) реакции гидроксилирования про биосинтезе гормонов коркового и мозговой части надпочечников 4) в составе оксигеназной системы микросом вит. С играет роль прооксиданта 5) стабилизирует вит. Е, выполняя антиоксидантную функцию 6) участвует в синтезе тироксина 7) защищает железо от окисления в тонком кишечнике, облегчая всасывание.
— ослабление иммунозащитных сил организма и усиление реакций свободнорадикального окисления.
Источник витамина С – растительная пища. Наиболее им богаты: шиповник, перец, черная смородина, укроп, петрушка, капуста, щавель, цитрусовые, земляника.
Суточная потребность: 100-200 мг (2.5мг/кг массы тела)
5.После принятия пищи концентрация глюкозы в крови может достигать 6 ммоль/л, глюкоза поступает в печень и превращается там в глюкозо-6-фосфат. Эту реакцию катализирует глюкокиназа (в других клетках гексокиназа). Глюкокиназа не ингибируется глюкозо-6-фосфатом.
Далее гл-6-ф может иметь различную судьбу:
— когда потребность в продуктах метаболизма в качестве источника топлива высока, происходит расщепление до ацетил-КоА, из которого затем синтезируются кетоновые тела.
— когда потребность в источниках энергии – продуктах внутриклеточного метаболизма низкая, происходит синтез триацилглицеролов, фосфолипидов, гликогена (запасание происходит под действием инсулина)
6.АТФ — универсальный источник энергии для всех биохимических процессов.
АТФ образуется при субстратном фосфорилировании и окислительном. В состоянии покоя АТФ расходуется на: мышечное сокращение (11%), биосинтез белка (21%), кальциевый насос (10%), натриевый насос (22%).
Реальная пропорция энергии из различных метаболических источников: жиры 40%, белки 15%, углеводы 42%, алкоголь 3%.
Желательная пропорция: жиры 30%, белки 15%, углеводы 55%, алкоголь 0%.
1.Гормон паращитовидной ж-зы – паратгормон, гормон, регулирующий обмен кальция и фосфора в организме, по природе является полипептидом. Паратгормон синтезируются в виде препропаратгормона, который затем поступает в шероховатую ЭПС, где происходит отщепление пептида. Затем пропаратгормон поступает в КГ, где отщепляется еще пептид.
Кроме паратгормона в организме синтезируется паратгормоноподобный белок, который может взаимодействовать с рецепторами к паратгормону.
Механизм действия: паратгормон взаимод. с 7-тмс-рец. = > активация аденилатциклазы = > повыш. уровня цАМФ, ионизированного кальция, ДАГ, инозитолтрифосфата = > активация остеокластов.
Основная функция: поддержание постоянного уровня кальция в крови за счет влияния на кости, почки, кишечник (через вит. Д).
2.Образовавшийся при распаде гемоглобина билирубин (Б.) поступает в кровь и там связывается с альбуминами плазмы (это непрямой Б.). Также имеется прямой Б.
Попадая в печень Б. ковалентно связывается с двумя мол. УДФ -глюкуроновой кислоты, образуя диглюкуронид билирубина, или связанный билирубин. Далее Б. поступает в тонкий кишечник, где из него образуется мезобилирубин, которые затем под действием микроорганизмов восстанавливается в уробилиноген, часть которого всасывается и поступает в печень (истинный уробилин), где разрушается. Большая часть уробилиногена поступает в толстый кишечник, где восстанавливается в стеркобилиноген (80% которого выделяется с калом) и под влиянием воздуха окисляется в стеркобилин, придающий характерную окраску стулу.
3.Антикоагуляционная система – ряд ингибиторов свертывания крови (антикоагулянтов), осуществляющих контроль скорости активирования факторов гемокоагуляции или реакций между ними.
Естественные (физиологические) антикоагулянты:
— первичные (синтезируются в организме и с постоянной скоростью выделяются в кровоток; взаимодействуют с активными факторами коагуляции, нейтрализуя их, и не действуют на неактивные формы)
— вторичные (образуются из факторов свертывания и других белков в процессе свертывания крови)
Основные физиологические антикоагулянты: антитромбин III, α2-макроглобулин, протеин С, протеин S.
4.Витамин В6 (пиридоксин, антидерматитный витамин)
Является коферментом (>100 реакций), больше всего в метаболизме АК.
— р-ции декарбоксилирования АК
— р-ции обезвреживания (окисления) биогенных аминов
— р-ции разрушения D -аминок-т
— синтезе гормонов щитовидной ж-зы и их распаде в периферических тканях
— превращении триптофана в ниацин
1) гипохромная анемия (нарушение синтеза гемма), судороги (недостаток ГАМК), менее часто – сухой себорейный дерматит, стоматит и глоссит.
2) у маленьких детей при искусственном вскармливании стерилизованным молоком (разрушается вит. В6)
3) у беременных при токсикозах
4) у взрослых при длительном лечении противотуберкулезными препаратами
5) у курильщиков уровень синтеза витамина снижен
Суточная потребность 2-2,2 мг. Частично синтезируется микрофлорой.
5.Сходные механизмы регуляции:
— разделение метаболических процессов по отдельным отсекам (компартментам): в цитозоле – гликолиз, пентозофосфатный путь, синтез ЖК; в митохондриях – цикл Кребса, окислительное фосфорилирование, β-окисление, синтез и утилизация кетоновых тел; в цитозоле и митохондриях – глюконеогенез, синтез мочевины.
6.Кроме трех основных питательных веществ – белков, жиров и углеводов, существует еще один источник энергии – алкоголь. Но если и белки, и жиры, и углеводы содержат полезные для организма вещества, то алкоголь – это чистые калории, переходящие сразу в жир.
Один грамм чистого алкоголя содержит минимум 7 калорий – это вдвое больше, чем в углеводах и белках, и практически столько же, сколько в жире.
Содержащийся в спиртных напитках алкоголь быстро всасывается в кровь (20 % из желудка и 80 % из кишечника). Метаболизм этанола заключается в окислении до ацетальдегида (очень реакционноспособное и в связи с этим ядовитое вещество) и затем до уксусной кислоты. (Превращение происходит прежде всего в печени.) Уксусная кислота затем включается в состав кофермента А и выступает как источник энергии организма, более легкодоступный, чем даже глюкоза.
1.Строение. 7-ТМС рецепторы являются интегральными мембранными белками с семью трансмембранными спиральными сегментами, соединенными гидрофильными внеклеточными и внутриклеточными петлями. Внутриклеточные петли этих рецепторов содержат центры связывания G-белка.G-белок-тримерный белок (α, β, γ), обладает ГТФ-азной активностью.
Механизм действия. После связывания сигнальной молекулы с рецептором клетки-мишени происходит замена ГДФ (который связан с α-субъединицей G-белка) на ГТФ, и G-белокдиссоциирует на α-субъединицу и димер субъединиц βγ. Далее – в зависимости от субклассаG-белка: если Gαs-белок-происходит активация аденилатциклазы (β-адренэргический рецептор);если Gαi-белок — ингибирование аденилатциклазы (α2-адренергический рецептор); если Gαq-белок – активация фосфолипазы С.
При контакте с α-субъединицей Gs-белка мембранный фермент аденилатциклаза активируется и катализирует образование вторичного посредника – цАМФ (повышение его концентрации в клетках кратковременно, распадается под действием фосфодиэстераз до 5-АМФ). цАМФ-аллостерический активатор протеинкиназы А.ПКА фосфорилируетключевой фермент (присоединяя фосфат к остаткам СЕР, ТРЕ).
Следующий класс 7-ТМС рецепторов связывается через Gq-белок с фосфолипазой С. При контакте с α-субъединицей фосфолипаза С катализирует гидролиз фосфатидилинозитолдифосфата на ДАГ и ИФ3. Последующие эффекты опосредуются либо ДАГ, либо ИФ3. 1). ИФ3 связывается с рецептором на поверхности ЭПР, открывая лигандзависимыеСа-каналы, что приводит к увеличению концентрации Са в цитозоле. Са связывается со специфическими Са-связывающими белками (калмодулином).Комплекс Са-калмодулин присоединяется к белкам-мишеням , изменяя их активность. Калмодулин является субъединицей Са-калмодулинзависимыхпротеинкиназ (СаМкиназы). СаМкиназыфосфорилируют ферменты-мишени, меняя их активность. 2). ДАГ две роли:
а). ДАГ может гидролизоваться с образованием арахидоновой кислоты, необходимой для синтеза простогландинов.
б). ДАГ способен активировать специфическуюпротеинкиназу (ПКС), которая фосфорилирует ряд белков.
2. Гемолитическая желтуха. Причины. Лабораторная диагностика.
(Надпеченочная желтуха). Причины: усиленный гемолиз эритроцитов (переливание несовместимой крови, резус-конфликт матери и плода), отравление солями тяжелых металлов, малярия, нарушение эритропоэза – пернициозная анемия, врожденные нарушения – серповидноклеточная анемия, талассемии, прием некоторых лекарственных препаратов.
Печень здорова и старается избыток непрямогобилирубина превратить в прямой и направить в кишечник. Следовательно, в кале и моче повышенстеркобилин. Тем не менее, печень не успевает превращать весь непрямой билирубин в прямой, поэтому непрямой повышен в крови. Цвет кала – темного шоколада, цвет мочи – буро-коричневый.
3. Витамин К – зависимые факторы свертывания крови: ф. II, ф.VII,ф.IX, ф.X. Особенностью всех витамин К-зависимых белков является формирование белковой сеточки, образованной γ-карбоксиглутаминовой кислотой, связанной с кальцием (такая сеточка была впервые описана для протромбина. Протромбин в присутствии Са связывается с биомембраной, что явл. необходимым условием процесса свертывания крови). А биологическая роль витамина К – он является коферментом γ-глутамилкарбоксилазы(катализирует карбоксилированиеглутамата с образованием γ-карбоксиглктаминовой кислоты). γ-карбоксиглутаминовая кислота является Са-связывающей аминокислотой, которая необходима для функционирования кальцийсвязывающих белков.
Роль витамина К в гемокоагуляции (работает в составе g-глутамилкарбоксилазы):
а) антигеморрагический фактор – пострансляционное созревание факторов II, VII, IX, X
б) участвует в созревании витамин К-зависимых антикоагулянтов (протеинов C и S)
Антивитамины вит. К.- антикоагулянты (варфарин, дикумарол, синкумар и др.)Дикумарол – антагонист витамина К, он ингибирует восстановление хиноновых производных витамина К в активные гидрохиноновые формы, препятствуя созреванию вит.К-зависимых факторов системы свертывания, что сопровождается выключением плазменных факторов VII, IX, X, II из процесса коагуляции крови. Свертывание крови в пробирке сохраняется при добавлении в нее дикумарола, т.к. дикумарол оказывает эффект не сразу, а спустя несколько часов или дней, действуя продолжительно.
4. Витамин Е. (токоферол, витамин размножения)
Альфа-токоферол содержит фенольное кольцо с системой сопряженных двойных связей, поэтому он легко отдает электрон свободным радикалам, восстанавливая их до стабильных продуктов. Феноксил-радикал, который при этом образуется, сам по себе достаточно стабилен и в продолжении цепи не участвует.
Витамин Е является основным жирорастворимым антиоксидантом:
Он участвует в перехватывании свободных радикалов
Защищает ненасыщенные жирные кислоты в мембранах и липопротеинах от ПОЛ
Угнетает активность ФЛ-А2 (ингибирует выработку лейкотриенов и простагландинов)
Защищает SH-группы мембранных белков
Способствует включению селена в активный центр ГП
Контролирует биосинтез убихинона
Регулирует биосинтез РНК (синтез гемсодержащих белков)
Частичный гемолиз эритроцитов, анемия
Повышение активности клеточных ферментов в крови
Увеличение содержания продуктов ПОЛ в крови
Бесплодие, невынашивание беременности
Суточная потребность – 10-20 мг. Пищевые источники: орехи, семечки, гречневая крупа, пшеничные проростки, зелень, сливочное масло, желток.
5. Основные особенности белков, жиров, УВ в печени после принятия пищи.
1. Поддержание ур-ня глюкозы на постоянном уровне: после принятия пищи концентрация глюкозы в крови достигает 6 и выше ммоль/л, она поступает в печень и превращается там в гл-6-фосфат, т.к.:
-противоположно миоцитам и адипоцитам инсулин не оказывает здесь прямого влияния на поглощение глюкозы
-интенсивность фосфорилирования глюкозы в печени пропорциональна концентрации глюкозы в крови
-в гл-6-фосфат в печени превращаются другие моносахариды, подвергшиеся всасыванию в кишечнике (фруктоза, галактоза)
2. увеличение утилизации АК для энергетических целей, усиленный гликолиз и активность пируват ДГ , увеличение синтеза гликогена, усиление синтеза ЖК.
3.ЖК используются для синтеза ТАГ, фосыолипидов, которые в составе липопротеинов секретируются в кровоток.
6. Реакции, позволяющие использовать жиры жировых депо в качестве источника энергии.
1. Гормоны половых желез: женские (эстроген, прогестерон, активин, ингибин, фолистатин, релаксин – синтезируются в яичниках), мужские (андрогены – тестостерон и дигидрокситестостерон, ингибин, активин – синтезируются в семенниках). Гормоны стероидной природы: эстроген, прогестерон, тестостерон, белковой природы: активин, фолистатин, ингибин, релаксин.
Механизм действия стероидных половых гормонов (андрогены,прогестерон), кроме эстрогенов: связываются с рецептором в цитоплазме.Рецептор состоит из трех доменов. Гормон связывается с доменом 1 (гормонсвязывающий домен).Происходит изменение конформации домена 1, эти изменения передаются домену 2 (ДНК-связывающему домену). Уходят белки теплового шока hsp,блокировавшие ДНК-связывающий домен, выходят 2 цинковых пальца и с их помощьюпроисходит димеризация 2-ух рецепторов – образуется гомодимер. Этот гомодимер перемещается в ядро и цинковыми пальцами связывается с ДНК. Активируется домен 3 (домен для связывания и активации факторов транскрипции).Рецепторы для эстрогеновпостроены аналогично цитозольным, но располагаются сразув ядре.
Эффект эстрогенов: стимулируют: 1) пролиферация эндотелия 2) возбудимость миометрия 3) рост протоков молочной железы 4) секреция пролактина (но не действие) 5) транспортные белки печени 6) анаболики 7) приводят к гипотермии 8) задерживают воду.
Функции прогестерона: стимулирует: 1) развитие желез матки, индуцирует превращение клеток стромы в децидуальные клетки 2) снижает возбудимость миометрия 3) рост альвеол грудной железы 4) катаболик 5) повышает температуру тела 6) натрийуретик
Эффект андрогенов: стимулирует: 1) сперматогенез 2) вторичные половые признаки 3) анаболик
2. Биосинтез гема и его регуляция. Нарушение биосинтеза гема (биохимическая диагностика).
1. ГЛИ + Сукцинил-SKoA = δ-аминолевулиновая кислота
Фермент-Аминолевулинат-синтаза, В6.
2. 2 δ-АЛК = Порфобилиноген (ПБГ)
Фермент-δ-аминолевулинатдегидратаза
3. 4 ПБГ = ПротопорфиринIX(ППIX)
Через ряд промежуточных стадий.
Фермент – гемсинтаза (феррохелатаза), вит. В 12, Сu.
Регуляция синтеза гема. Фермент, лимитирующий скорость синтеза гема (фермент 1). Он ингибируется избытком гема по принципу обратной связи, а активируется стероидными гормонами. Также ингибируется избытком гема ферменты 2 и 3(гемсинтаза). Фермент 2 чувствителен ко всем тяжелым металлам. Фермент 3 чувствителен к свинцу.
Нарушения синтеза гема. Заболевания, вызванные наследственными или приобретенными нарушениями синтеза гема – порфирии. Характерно выделение предшественником гема – порфиринов – с калом и мочой, которая окрашивается в темно-красный цвет. Порфирины также откладываются в коже,и при воздействии солнечного света образуются трудноизлечимые волдыри. Части и нервно-психические расстройства, т.к. порфиринынейротоксичны.
3.Роль тромбоцитов в процессе гемокоагуляции:
1. участвуют, как и другие клетки крови, в образовании первичного клеточного тромба
2. участвуют в активации гемокоагуляции (создают поверхность для взаимодействия и активирования факторов свертывания крови)
3. защищают факторы свертывания от разрушения ингибиторами плазмы
4. выделяют факторы, активирующие процесс тромбообразования (выделяют гемокоагуляционные факторы)
4. Витамин С. (аскорбиновая к-та – восстановленная форма
дегидроаскорбиновая к-та – окисленная).
Отрыв одного электрона от аскорбиновой кислоты приводит к образованию семидегидроаскорбата, который в результате дальнейшего окисления переходит в дегидроаскорбат. Защитный эффект аскорбата основан на том, что образующиеся в результате его окисления промежуточные радикалы и молекулы менее активны, чем НО˙ радикалы.
Витамин С и витамин Е являются сопряженными антиоксидантами
Радикал токоферола (TФ-O) является более сильным окислителем, чем аскорбат. Это означает,что AСК может восстанавливать TФ-O:
Аскорбиновая кислота – это антиоксидант-восстановитель:
Действует внутри и внеклеточно.
Участвует во многих ОВР в организме
Обезвреживает СР кислорода и липидов (О2•, Н2О2 , ОН•,НО2•,ROO•)
Участвует в образовании активной формы вит. В9
Защищает Se и Fe2+ от окисления (Нb, трансферрин,цитохром Р450)
Предотвращает образования нитрозаминов.
Участвует в реакциях гидроксилирования (коллаген, стероидные гормоны, серотонин, карнитин)
Витамин С– прооксидант:
При дефиците Vi Епрооксидантный эффект Vit C на 2 порядка!
2Fe3+ + аскорбат → 2Fe2+ + дегидроаскорбат
Суточная потребность – не -6 -10 -12 М)
2) обязательна связь с рецептором, включающая каскадный механизм и усиление гормонального сигнала (на поверхности клетки, в цитоплазме или ядре)
3) изменение скорости синтеза ферментов и их активности
4) регуляция секреции по принципу прямой или обратной связи
Гормоны — вещества орг природы, вырабатывающиеся в специализированных клетках желез внутренней секреции, поступающие в кровь и оказывающие регулирующие влияния на обмен веществ и физиологические функции.
1.Сложные белки — гликопротеины
2. простые белки (пролактин, инсулин. )
3. пептиды (глюкагон, кальцитонин)
4.производные аминокислот (катехоламины)
5.стероидные соединения и производные жирных кислот (простагландины).
Гиповитаминоз.
Недостаток витамина Д у детей – рахит: деформация скелета конечностей (искривление их в результате размягчения – остеомаляции), черепа (позднее заращение родничков), грудной клетки (появление своеобразных «четок» на костно-хрящевой границе ребер), задерживается прорезывание зубов, развивается гипотония мышц (увеличенный живот), возрастает нервно-мышечная возбудимость (у младенца выявляется симптом облысения затылочка из-за частого вращения головкой), возможно появление судорог.
У взрослого: кариес и остеомаляция (размягчение кости); у пожилых – развитие остеопороза. Разрушение неорганического матрикса объясняется усиленным «вымыванием» кальция из костной ткани и нарушением реабсорбции кальция в почечных канальцах при дефиците витамина Д:
Гипервитаминоз.
Избыточный прием витамина Д интоксикация, сопровождается выраженной деминерализацией костей вплоть до их переломов. Содержание кальция в крови повышается. Это сопровождается кальцификацией мягких тканей, особенно склонны к этому процессу почки (образование камней, развитие почечной недостаточности).
Пищевые источники. Витамин Д3 содержится исключительно в животной пище. Особенно богат им рыбий жир, также печень, желтки яиц.
Суточная потребность для детей колеблется от 10 до 25 мкг (500-1000 МЕ), у взрослых она ниже.
5.принципиальные составляющие интеграции метаболизма:
Интеграция метаболизма определяется:
наличием общих промежуточных продуктов в большей части метаболических путей
возможностью взаимопревращений через общие метаболиты
использованием общих коферментов и необходимостью их постоянной циркуляции
наличием общего пути катаболизма и единой системы освобождения и использования энергии (дыхательная цепь)
наличием сходных механизмов регуляции
6.Белки как источники энергии.
Аминокислоты являются важным метаболическим источником энергии. В печени происходит расщепление аминокислот с образованием различных промежуточных метаболитов. Запасы гликогена в печени недостаточны, чтобы поддерживать потребность орг в глюкозе юолее 6 часов послеприема пищи. Спустя этот период времени основным источником глюкозы становится глюконеогенез из аминокислот (аланина и глутамина).
1. Гормоны мозгового слоя надпочечников: катехоламины (адреналин, норадреналин). Химическая природа: производные АК. Механизм действия (цАМФ):1) секрецию глюкагона и ¯ секрецию инсулина 2) секрецию паратирина 3) гликогенолиз 4) глюконеогенез в печени 5) липолиз.
2. Энзимодиагностика заболеваний печени:
С помощью биохимических тестов можно выявить изменения при поражении менее 5% паренхимы печени, тогда как клинически заболевание проявляется при поражении >80%.
1. Исследование белкового спектра крови.
а) альбуминово-глобулиновый коэффициент А/Г = 1,5-1,7 в норме. При острых поражениях А/Г¯ за счет уменьшения уровня альбуминов, при хронических – за счет повышения глобулинов.
б) определение коллоидной устойчивости (тимоловая и сулемовая проба, проба Самая на b-ЛПН). Первые две положительны при паренхиматозной желтухе и отрицательны при механической, проба Самая – наоборот.
2. Исследование пигментного обмена.
3. Исследование антитоксической функции. Используются нагрузочные тесты (проба Квика-Пытеля): после приема бензоата натрия он в печени соединяется с глицином с образованием гиппуровой кислоты, которую определяют в моче.
4. Исследование дезаминирования в печени. Если остаточный азот повышен за счет азота АК, это значит, что страдает дезаминирование АК в печени, если увеличение остаточного азота происходит за счет мочевины, это скорее свидетельствует о нарушении азотовыделительной функции почек.
5. Исследование мочевинообразовательной функции.
Азот мочевины / остаточный азот = 0,5 в норме, при поражениях печени снижается.
6. Исследование гомеостатической функции.
а) нагрузочная проба галактозой – в норме выведение галактозы в моче не превышает 8% через 12 ч.
б) нагрузочная проба глюкозой.
7. Исследование активности ферментов плазмы крови, характеризующих печеночный обмен.
При заболеваниях паренхимы в крови резко увеличен уровень органо-специфического фермента – фруктозо-1-фосфат альдолазы, а также возрастает активность АлАТ и в меньшей степени АсАТ. Увеличена активность ЛДГ5, резко снижена активность холинэстеразы.
При незначительных поражениях гепатоцитов: в плазме крови увеличивается активность цитоплазматических ферментов печени (АлАТ, АсАТ, сорбитолдегидрогеназы, g-глутамилтранспептидазы).
При сильном поражении гепатоцитов повышается активность митохондриальных ферментов: глутамилдегидрогеназы, митохондриальной АсАТ.
При механической желтухе в крови возрастает щелочная фосфатаза и лейцинаминопептидаза.
При длительном декомпенсированном поражении снижается активность холинэстеразы, ЛХАТ, содержание факторов свертывания крови и общее содержание белков крови.
3. Наиболее значимые естественные антикоагулянты:
а) антитромбин III – необратимо ингибирует большинство сериновых протеаз свертывающей системы (ф. IIa, IXa, Xa, XIa, XIIa), основной плазменный кофактор гепарина, особенно ингибирует тромбин.
б) гепарин – в 1000 раз повышает активность антитромбина III.
в) протеины C и S – разрушают факторы ф.Va, VIIIa и ингибируют образование фактора Xa и тромбина.
г) α2-макроглобулин – препятствует действию тромбина на фибриноген
д) ЛАКИ – ингибирует внешний механизм свертывания, связываясь с факторами VIIa и Xa.
4.Витамин В6(пиридоксин, антидерматитный)
Источники. Мясо, рыба, бобовые, орехи, зерновые, картофель.
Суточная потребность около 2 мг в сутки.
Последнее изменение этой страницы: 2017-01-24; Нарушение авторского права страницы
источник