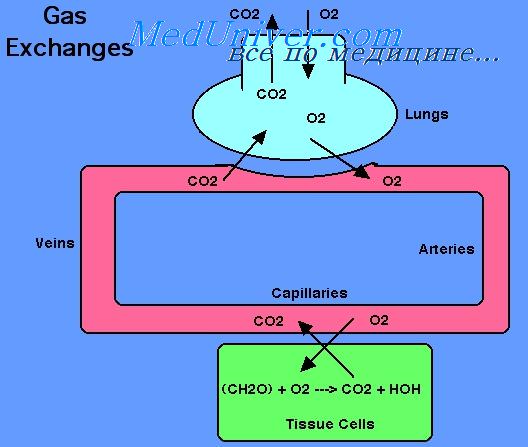
Сколько молекул кислорода транспортирует одна молекула гемоглобина
Обычно из легких в ткани переносятся эритроцитами в химической связи с гемоглобином около 97% кислорода. Оставшиеся 3% кислорода транспортируются в физической растворенной форме плазмой крови. Таким образом, в нормальных условиях почти весь кислород переносится в ткани, будучи связанным с гемоглобином.
Химический состав гемоглобина представлен в наших остальных статьях, где говорилось, что молекула кислорода легко и обратимо связывается с гемом гемоглобина. При высоком Ро2, как это бывает в легочных капиллярах, кислород связывается с гемоглобином, а при низком Р02, как в капиллярах тканей, кислород освобождается от связи с гемоглобином. Такой механизм обеспечивает почти весь транспорт кислорода из легких в ткани.
Кривая диссоциации оксигемоглобина. На рисунке приведена кривая диссоциации оксигемоглобина, демонстрирующая прогрессивный прирост процентной доли оксигемоглобина (процента насыщения гемоглобина кислородом) при увеличении Ро2 в крови. В крови, покидающей легкие и входящей в системные артерии, напряжение О2 обычно составляет примерно 95 мм рт. ст., и на кривой диссоциации видно, что насыщение системной артериальной крови кислородом составляет 97%.
В нормальной возвращающейся из периферических тканей венозной крови напряжение О2 составляет около 40 мм рт. ст. и 75% — насыщение гемоглобина кислородом.
Максимальное количество кислорода, которое может находиться в связи с гемоглобином крови. В 100 мл крови здорового человека содержится около 15 г гемоглобина, и каждый грамм гемоглобина может связать максимально 1,34 мл кислорода (химически чистый гемоглобин может связать 1,39 мл кислорода, но примеси типа метгемоглобина снижают это количество). Итак, 15×1,34 = 20,1, значит, в среднем содержащееся в 100 мл количество гемоглобина при 100% насыщении может связать около 20 мл кислорода. Обычно это обозначают как 20 об% (объемных процентов).
Кривая диссоциации оксигемоглобина может строиться не от процентного насыщения гемоглобина кислородом, а от количества содержания объемных процентов кислорода.
Количество кислорода, высвобождаемого гемоглобином во время прохождения артериальной крови через ткани.
В обычных условиях в системной артериальной крови, насыщенной кислородом на 97%, общее количество связанного с гемоглобином кислорода составляет около 19,4 мл на 100 мл крови. При прохождении через капилляры ткани этот объем снижается до 14,4 мл (Р02 — 40 мм рт. ст., насыщение гемоглобина — 75%). Итак, в нормальных условиях каждые 100 мл крови доставляют от легких к тканям около 5 мл кислорода.
При тяжелой физической работе мышечные клетки потребляют кислород с повышенной скоростью, что может привести к падению Р02 в интерстициальной жидкости мышцы от нормального уровня 40 мм рт. ст. до 15 мм рт. ст.
При таком низком парциальном давлении в каждых 100 мл крови остается только 4,4 мл связанного с гемоглобином кислорода. В этом случае каждые 100 мл протекающей крови отдают тканям 19,4 — 4,4, или 15 мл кислорода, т.е. каждый объем крови отдает тканям в 3 раза больше кислорода, чем в покое. Вспомните, что у хорошо тренированных бегунов-марафонцев сердечный выброс может увеличиться в 6-7 раз, чем при покое.
Если умножить это увеличение сердечного выброса (6-7 раз) на увеличение высвобождения кислорода в тканях каждым объемом крови (3 раза), получается, что к тканям было доставлено в 20 раз больше кислорода, чем в покое. Далее в этой главе Вы узнаете о существовании других факторов, улучшающих доставку кислорода в ткани во время физической нагрузки, поэтому даже при очень напряженной физической работе наблюдается только очень небольшое снижение Ро2 в мышечной ткани.
источник
Путь кислорода в теле. Прием гемоглобином кислорода
В предыдущей статье мы рассмотрели, как кислород прошел альвеолярно-капиллярную мембрану и проник в кровеносный сосуд. Здесь он встречается с гемоглобином, который должен транспортировать его к клеткам. Читайте последовательно, или переходите по ссылкам.
И ВОТ О2 ПРОНИКАЕТ В КРОВЬ..
Часть II. Транспорт кислорода.
Гемоглобин
У крови много функций. Главная из них — перенос кислорода. Доставить весь кислород от легких к тканям в виде физически растворенного газа в крови невозможно — в плазме крови растворяется всего 3 %, так как кислород почти не растворяем в плазме и воде [ 1 ]. Поэтому для его транспортировки организм выделяет специфический белок крови — гемоглобин (Hb).
Гемоглобин находится в красных кровяных клетках, которые на греческом языке называются «эритроциты». Общая поверхность всех циркулирующих в крови эритроцитов 3800 м 2 .
Количество физически растворенного в крови кислорода мало и не играет значимой роли в его транспорте: при paO2 100 мм рт. ст. в литре крови O2 растворено всего 3,1 мл/л (СO2 – 45 мл/л). Если бы гемоглобина не существовало, адекватная доставка кислорода была бы возможной лишь при сердечном выбросе, превышающем 120 л/мин! [ 2 ] Однако эти 3 % важны, поскольку кислород из альвеол в кровь и эритроцит, и из капилляров к тканям проходит через физическое растворение.
Основное количество O2 переносится в связанном с гемоглобином виде.
Связывание кислорода гемоглобином (Нb + O2 = НbO2) происходит в капиллярах легких. В основном это получается за счет высокого парциального давления О2 в альвеолах (100 мм рт. ст.). Скорость прохождения крови в капиллярах легких, в среднем, составляет 0,5 с, но скорость оксигенации еще быстрей — всего 0,01 с.
Степень нормального насыщения кислородом артериальной крови 98 – 100 %. Но бывает и так, что кислородная емкость крови слишком мала. Тогда говорят о малокровии (анемии). Причина — нехватка эритроцитов в крови, или недостаток гемоглобина в эритроците. Это ситуация, когда желающих «сесть на поезд» много, а вагонов или мест в них мало.
Недостаток эритроцитов в крови
Причин недостаточного количества эритроцитов в крови может быть множество:
· Недостаточное образование эритроцитов — дефицит белка, железа, фолиевой кислоты, витамина B12 и др. Дефицит может быть при недостаточном поступлении с пищей или при нарушении их усвоением желудком и кишечником.
В каждой молекуле гемоглобина 4 атома железа, а всего его в организме около 4,5 г. За сутки мужчины теряют около 1 мг железа, а женщины — до 3 мг. В период менструаций потери возрастают до 14 мг. В период беременности потери составляют в сумме 700-800 мг, а за весь период лактации — 400 мг. Поэтому и мужчинам, и, особенно, женщинам, необходима постоянная компенсация железа.
· Дефицит железа в пище или низкая его усвояемость приводят к развитию железодефицитной анемии. Она часто встречается у женщин при беременности. При этом снижаются цветовой показатель ниже 0,8, уровень эритроцитов — ниже 3,6×1012/л, гемоглобин — ниже 110 г/л. [ 3 ];
· Разрушение эритроцитов раньше срока. В норме срок жизни эритроцита 120 дней. Инфекции, вирусы и грибки сокращают срок его службы (см. ниже);
· Беременность. Эстрогены тормозят эритропоэз, поэтому в период беременности уровень эритроцитов часто снижен (присутствует анемия) [ 4 ];
· Наследственное генетическое заболевание крови;
· Кровопотеря. Количество эритроцитов в крови сокращается в результате острой или хронической кровопотери – ранения, кровоточащая язва желудка, геморроидальные узлы и др.;
· Прием некоторых препаратов. Например, фенобарбитал является частью популярных сердечных и успокоительных средств (корвалол и др.). При частом использовании может привести к эритропении. Неблагоприятное воздействие на эритроциты оказывает химиотерапия.
Недостаток гемоглобина в эритроцитах
Теперь рассмотрим ситуацию, когда в крови достаточно эритроцитов, но концентрация общего гемоглобина ниже нормы.
В одном эритроците 270 миллионов молекул гемоглобина. Если микроскоп показывает мембраны эритроцитов однородной окраски — в них 100 % содержание гемоглобина. Но очень часто можно встретить внутри эритроцита белое кольцо, которое лишь снаружи окрашено в розовый цвет — в нем гемоглобина всего 50-60 %, то есть меньше чем у здорового эритроцита. Если таких эритроцитов будет более 30 %, показатель общего гемоглобина снижается, и врачи ставят диагноз анемия.
Люди, страдающие анемией бледны, словно им и в самом деле не хватает крови. При недостатке гемоглобина кровь несет тканям недостаточное количество кислорода и в них возникает гипоксия. В результате производится меньше энергии, и люди быстрее устают.
Почему не хватает гемоглобина в эритроцитах?
· Гемоглобин это белок. Дефицит белка означает, что у этого человека в рационе питания мало качественного белка.
· Агрессия вирусами, грибками, паразитами и прочими простейшими. При осмотре через микроскоп, на это указывают неровные края мембраны эритроцита, что указывает на его повреждение. Еще можно увидеть, как к мембране эритроцита прикрепляются нитиевидные образования, которые используют его как сырьевую базу. Гемоглобин едят грибки, вирусы и паразиты, они любят его, он для них он важен. [ 5 ]
· Молекула гемоглобина состоит из 514 аминокислот, из которых 7 в организме не синтезируются. Они должны поступить в наше тело только с едой. Обзор необходимых аминокислот для высокого гемоглобина см. здесь.
· Некоторые люди по наследству через гены получают заболевание крови — гемоглобиноз, при котором гемоглобин имеет низкую способность транспортировать кислород.
Бывает и обратная ситуация, при которой в крови образуется слишком большое количество эритроцитов. Это состояние называется полицитемией (от греч. «много клеток в крови»). Слишком много эритроцитов сгущает кровь, делает ее более вязкой. Это препятствует нормальной циркуляции крови и насыщению кислородом тканей.
Когда человек живет высоко в горах, полицитемия только желательна, но на уровне моря она может стать опасной. Поэтому спускающиеся с гор люди проходят акклиматизацию, как и равнинный житель в горах, только здесь наоборот.
Дисгемоглобин
Осталось рассмотреть еще одну ситуацию, которая может помешать кислороду зайти в эритроцит. Это тот случай, когда поезда в расписании есть, билет куплен, но увы, место занято другим пассажиром.
Гемоглобин собирает исключительно молекулы кислорода («на этом поезде места для тех кто купил билеты»). Однако некоторые газы могут этому помешать — это дисгемоглобины («хулиганы без билетов»). Слишком высокая концентрация дисгемоглобинов (COHb и MetHb) приводит к падению активной и эффективной концентрации гемоглобина и, соответственно, к гипоксии.
При отравлении угарным газом образуется карбоксигемоглобин (COHb), а при отравлении гипербарическим кислородом — метгемоглобин (MetHb). Карбоксигемоглобин и метгемоглобин не способны присоединять и транспортировать кислород.
· Отравление угарным газом (СО, окись углерода). Если при недостатке кислорода сжечь углеродсодержащее вещество, например, уголь или бензин, образуется угарный газ. Попадая в кровь с дыханием, молекула гемоглобина присоединяет к себе угарный газ вместо кислорода, и становится бесполезной для дыхания клеток. Способность присоединяться к гемоглобину у угарного газа в 300 раз выше, чем у кислорода, а его отделение от гемоглобина происходит в 10 000 раз медленнее, чем у кислорода [ 6 ].
Если угарный газ вывел из строя небольшое количество гемоглобина, последствия не будут серьезными. Но угарный газ имеет отвратительное свойство, которое делает его особенно опасным — цепляясь к атому железа, СО создает трудноразъединимое соединение — карбоксигемоглобин (Нb + СO = НbСO). В отличие от молекулы кислорода, он не может легко освободиться от гемоглобина, когда кровь завершает свой круг в организме и возвращается в легкие. Происходит процесс накопления.
И хотя содержание угарного газа в воздухе мало, со временем большая часть гемоглобина в крови начинает циркулировать впустую. Если в воздухе содержится 0,1 % CO, то около 80 % Hb крови превращается в НbСO. Карбоксигемоглобин не может связывать кислород, и в итоге постепенно развивается удушье.
Угарный газ попадает к нам в организм с выхлопным дымом автомобилей, выбросом промышленных предприятий, с сигаретным дымом и др.
В норме содержание НbСO в крови составляет 1 %. У курильщиков НbСO значительно выше — после выкуренной сигареты его содержание может возрасти до 5 % и более, а к вечеру доля НbСO может возрасти до 20 % общего гемоглобина в крови. [ 7 ] При содержании в крови 20 – 25 % НbСO человеку требуется специфическая врачебная помощь: дать чистый кислород, желательно под повышенным давлением.
· Сильные окислители. При действии сильных окислителей О2 может образовывать прочную химическую связь с железом гема, при которой атом железа становится трехвалентным. Такое соединение гемоглобина с кислородом называют метгемоглобином. Метгемоглобин не высвобождает кислород в тканевых капиллярах.
Метгемоглобинемия может быть врожденной, или развиться в результате некоторых видов острых химических отравлений (анилиновые красители, парацетамол, перманганат калия и пр.). Даже в обычных условиях у здоровых людей до 3 % гемоглобина крови может быть в виде метгемоглобина из-за постоянного поступления в кровь окислителей — перекиси, нитропроизводных органических веществ и др.
· Другие вещества. Гемоглобин легко взаимодействует и со многими другими растворенными в крови веществами. В частности, при взаимодействии с лекарственными препаратами, содержащими серу (например, принятие серных ванн), может образовываться сульфгемоглобин, сдвигающий кривую диссоциации НbO2 вправо.
Сатурация
Когда кислород (O2) соединяется с гемоглобином (Hb), он становится оксигемоглобином (HbO2). Кровь при этом приобретает ярко-алый цвет, что типично для артериальной крови. Венозная кровь содержит меньше кислорода, поэтому её цвет более темный.
У гемоглобина, как у транспортного белка, две задачи: присоединять кислород в легких и отдавать его тканям. Эти задачи противоположны по своей сути, но выполняются одним и тем же веществом. Поэтому стремление гемоглобина связываться с кислородом должно быть достаточным, чтобы обеспечить кровь кислородом, но не избыточным, чтобы не нарушить процесс отдачи кислорода клеткам.
Для обозначения меры насыщения кислорода гемоглобином, был придуман термин — сатурация (SO2). Динамическая взаимосвязь SO2, и давления кислорода в крови (pO2), дает кривую диссоциации HbO2 (рис. 1).
Середину этой кривой отметили точкой, при которой 50 % молекул гемоглобина связаны кислородом — это называют парциальным напряжением полунасыщения и обозначают как P50 (рН 7,4 температура 37 °С).
Увеличение P50 говорит о снижении сродства гемоглобина к кислороду, а его снижение — о возрастании.
Рис. 1-1; 1-2. Кривая диссоциации оксигемоглобина и ее характеристики:
А — кривая диссоциации оксигемоглобина и содержание кислорода в крови;
Б — смещение кривой диссоциации оксигемоглобина (сдвиг P50) облегчает захват O2 в легких и способствует диссоциации Hb – O2 на уровне тканей.
На «артериальной» части кривой существенное изменение PaO2 сопровождается незначительным сдвигом SO2. На «венозном» сегменте, напротив, небольшие изменения PO2 сопряжены с выраженным отклонением SO2
Напряжение кислорода (рО2)
Парциальное давление, или напряжение — выступает в качестве движущей силы перемещающей оксигемоглобин (HbO2) в организме. На протяжении всего пути кислорода, он будет перемещаться из зоны более высокого давления, в более низкую.
В атмосфере парциальное давление кислорода 150 – 160 мм рт. ст., а в конечной точке его путешествия — контуре респиратора митохондрии — pО2 всего 1 – 3 мм рт. ст. Таким образом, при прохождении кислорода к клеткам напряжение кислорода последовательно снижается, поскольку каждый этап транспорта связан с существенными издержками. Это явление получило название «кислородного каскада» (рис. 2).
Рис. 2. «Кислородный каскад». Описывает падение парциального давления кислорода, начиная от атмосферного воздуха и заканчивая мембраной митохондрий, конечного получателя кислорода.
Давайте посмотрим как это работает. Вдохнув воздух, парциальное давление кислорода в котором составляет 158 мм рт. ст., он попадает в верхние дыхательные пути, где нагревается и увлажняется. При прохождении области водяных паров (до 100 % относительной влажности), давление падает до 148 мм рт. ст. [ 8 ]
В альвеолах кислород смешивается с покидающим организм углекислым газом, что в обычных условиях уменьшает давление PO2 в альвеолярном воздухе до 103 – 107 мм рт. ст. Его могут уменьшить загрязнения вдыхаемого воздуха различными газами или нарушения легочной вентиляции [ 9 ], мы об этом говорили выше.
Потеря давления кислорода на альвеолярно-капиллярной мембране невелика — всего 1 мм рт. ст. Внутрилегочное шунтирование в артериальную кровь снижают PO2 до 90 – 100 мм рт. ст. В капиллярах тканей напряжение О2 падает до 40 мм рт. ст. Здесь кислород поступает в клетки органов и тканей — на поверхностях клеток парциальное давление составляет около 20 мм рт. ст., а в клеточных митохондриях — около 1 %. Когда PO2 в клетке становится равным 0,1 мм рт. ст. клетка погибает. [ 10 ]
Как мы видим, потеря кислорода может происходить на каждой из ступеней каскада.
Кроме парциального давления кислорода, на связывание гемоглобином кислорода влияют ряд вспомогательных факторов: напряжение углекислого газа (раCО2); температура легких (t °C); увеличение рН крови (эффект Вериго-Бора); и содержание в эритроците 2,3-ДФГ. Рассмотрим их.
Напряжение углекислого газа (раCО2)
Кроме транспорта кислорода к тканям, гемоглобин осуществляет обратный транспорт из клеток их конечного газового метаболита — углекислого газа (СО2). Содержание СО2 в венозной крови составляет 15 – 20 % [ 11 ].
Венозная кровь отдает альвеолам СО2, в результате чего в крови легочных капилляров снижается парциальное давление углекислого газа (рСО2). Это повышает сродство гемоглобина к кислороду, что приводит к насыщению артериальной крови кислородом.
В нормальных условиях у человека, при t 37 °С, рН 7,40 и pСO2 = 40 мм рт.ст. – p50 = 27 мм рт.ст.
Температура в лёгких
Реакция насыщения кислородом (оксигенации) гемоглобина, как и большинства химических реакций в организме, зависит от температуры. Мы это видели на примере работы ферментов. Оптимальная температура тела, является ключевым условием для поддержания Здоровья.
При понижении температуры легких присоединение О2 к гемоглобину ускоряется. Мы видим что с падением температуры кривая диссоциации НbО2 сдвигается влево (см. рис. 3). В этом случае гемоглобин активнее захватывает кислород, но в меньшей мере отдает его тканям.
Рис. 3. Кривые диссоциации оксигемоглобина:
а) — при одинаковой температуре (Т = 37 °С) и различном парциальном давлении углекислого газа (pCO2);
б) — при одинаковом pCO2 (40 мм рт. ст.) и различной температуре.
По вертикали отмечен процент молекул гемоглобина связанных с кислородом (НbO2), а по горизонтали — уровень напряжения кислорода (рO2).
Содержание в эритроците 2,3-ДФГ
2,3 Дифосфоглицерат (ДФГ) является промежуточным продуктом бескислородного производства АТФ (см. гликолиз). 2,3-ДФГ служит некоторой защитой от гипоксии в случае снижения поступления кислорода при ситуациях подъема в горы на высоту свыше 3-х км над уровнем моря, при хронических заболеваниях легких, сердечной недостаточности с цианозом, недостатка гемоглобина и других патологических причин, которые снижают поступление кислорода клеткам.
Например, при дыхательной недостаточности наблюдается резкий подъем уровня 2,3-ДФГ, который сохраняется на протяжении всего срока заболевания. Есть взаимосвязь между степенью тяжести дыхательной недостаточности, выраженностью дыхательной гипоксемии и уровнем 2,3-ДФГ.
В случаях нехватки кислорода в тканях, синтез 2,3-ДФГ в эритроцитах увеличивается, и отделение О2 от НbO2 ускоряется, что частично компенсирует кислородный голод тканей. У пожилых людей содержание 2,3-ДФГ в эритроцитах повышено, что указывает на отчаянную попытку организма препятствовать развитию гипоксии тканей.
Процесс старения сопровождается появлением новых качеств, направленных на сохранение компенсаторных механизмов, однако они лишь в неполной мере поддерживают процессы адаптации [ 12 ].
У тренирующих выносливость спортсменов, концентрация 2,3-ДФГ в эритроцитах на 15 – 20 % выше, чем не у спортсменов [ 13 ]. В норме содержание 2,3-ДФГ в сыворотке крови составляет 1,6 – 2,6 ммоль/л.
В крови мужчин уровень эритроцитов в норме 4 – 5,1 х1012/л, в крови женщин — 3,7 – 4,7х1012/л.
В норме уровень гемоглобина у мужчин 130 – 160 г/л, у женщин — 115 – 145 г/л. Обычно его определяют с помощью гемометра Сали, но этот метод дает до 30 % ошибку, поэтому лучше использовать гемоглобинцианидный или другие методы. [ 14 ]
Содержание оксигенированного гемоглобина (НbО2) в артериальной крови выше 94 % считается нормой. При содержании 90 % ткани испытывают кислородное голодание и необходимо принимать срочные меры, улучшающие доставку в них кислорода.
Если мы не живем высоко в горах, у нас нет хронических болезней легких, и наши альвеолы не забиты пылью и табачной смолой, при этом у нас сбалансировано питание, хороший гемоглобин, мы не работаем в холоде и дышим воздухом без превышения ПДК — нам не стоит особенно волноваться о проблеме насыщения гемоглобина кислорода пришедшего из лёгких.
Большинство людей всегда имеет высокое насыщение крови кислородом — содержание НbО2 в возвращающейся из капиллярной сети в легкие венозной крови составляет 67 – 75 % [ 15 ]. Как увеличить отдачу тканям уже имеющегося кислорода в крови — вот задача достойная самого пристального нашего внимания. Как это делают термальные бикарбонатные ванны, мы узнаем чуть дальше.
Сейчас мы остановились на том, что НbО2 должен «доехать» до места назначения — например, к мизинцу левой ноги. Успех его доставки будет зависеть от состояния кровеносных сосудов и густоты крови. Давайте это рассмотрим прямо сейчас.
источник