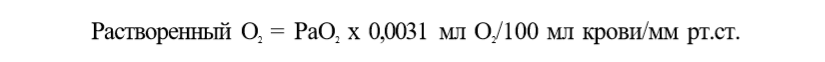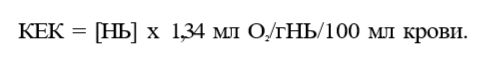Смещение кривой диссоциации гемоглобина
Кривые диссоциации оксигемоглобина справедливы для нормальной крови со средними показателями. Однако существует ряд факторов, которые могут сдвигать эту кривую в одну или другую сторону. На рисунке видно, что при некотором закислении крови со снижением рН от нормального уровня 7,4 до 7,2 кривая диссоциации смещается в среднем на 15% вправо, а повышение уровня рН от нормального уровня 7,4 до 7,6 смещает кривую на такое же расстояние влево.
Кроме изменений рН известны и другие факторы, которые могут сдвигать кривую диссоциации. Назовем три, действие которых сдвигает кривую вправо: (1) повышение концентрации двуокиси углерода; (2) повышение температуры крови; (3) повышение концентрации 2,3-дифосфоглицерата — метаболически важного фосфата, который в зависимости от метаболических условий присутствует в крови в разных концентрациях.
Повышение снабжения тканей кислородом в случаях, когда двуокись углерода и ионы водорода сдвигают кривую диссоциации оксигемоглобина. Эффект Бора. Сдвиг кривой диссоциации оксигемоглобина в ответ на повышение содержания двуокиси углерода и ионов водорода в крови имеет существенное влияние, выражающееся в ускорении высвобождения кислорода из крови в тканях и увеличении оксигенации крови в легких. Это называют эффектом Бора и объясняют его следующим образом.
При прохождении крови через ткань двуокись углерода диффундирует из клеток ткани в кровь. В результате в крови увеличивается Ро2, а затем концентрации угольной кислоты (Н2СО3) и ионов водорода. Эти изменения сдвигают кривую диссоциации оксигемоглобина вправо и вниз, уменьшая сродство кислорода к гемоглобину, и в результате увеличивается выход кислорода в ткани.
При диффузии двуокиси углерода из крови в альвеолы происходят процессы обратного направления — в результате в крови снижаются Рсо2 и концентрация ионов водорода, сдвигая кривую диссоциации оксигемоглобина влево и вверх. При этом’ значительно увеличивается количество кислорода, связывающегося с гемоглобином при любом существующем уровне альвеолярного Ро2, что увеличивает транспорт кислорода к тканям.
Сдвиг кривой диссоциации оксигемоглобина под влиянием дифосфоглицерата. Нормальное содержание ДФГ в крови вызывает постоянный небольшой сдвиг кривой диссоциации оксигемоглобина вправо. В случае гипоксического состояния, продолжающегося более нескольких часов, концентрация ДФГ в крови значительно возрастает, и кривая диссоциации оксигемоглобина сдвигается вправо еще больше.
В присутствии такой концентрации ДФГ кислород в тканях высвобождается при Ро2, превышающем нормальный уровень на 10 мм рт. ст., поэтому в некоторых случаях такой механизм с участием ДФГ может оказаться важным для адаптации к гипоксии, особенно если причиной гипоксии является уменьшение в ткани кровотока.
Сдвиг кривой диссоциации во время физической нагрузки. Во время физической нагрузки некоторые факторы вызывают значительный сдвиг кривой диссоциации оксигемоглобина вправо, поэтому активные, выполняющие физическую работу мышечные волокна получают дополнительное количество кислорода. В свою очередь, работающие мышцы высвобождают большое количество двуокиси углерода; это в совокупности с действием некоторых других кислот, высвобождающихся мышцами, повышает концентрацию ионов водорода в крови капилляров мышц.
Кроме того, во время работы температура мышцы часто повышается на 2-3°С, что может еще больше увеличивать доставку кислорода мышечным волокнам. Все эти факторы вызывают значительный сдвиг кривой диссоциации оксигемоглобина в крови капилляров мышц вправо. Сдвиг вправо означает высвобождение кислорода гемоглобином в мышце при достаточно высоком уровне Ро2 (40 мм рт. ст.) даже в случаях, когда из него уже высвободилось 70% кислорода. Сдвиг кривой в другую сторону показывает, что в легких присоединилось дополнительное количество кислорода из альвеолярного воздуха.
источник
23. Транспорт кислорода. Кривая диссоциации оксигемоглобина.
О2 переносится к тканям в двух формах: связанный с гемоглобином и растворенный в плазме. В крови содержится лишь незначительное количество О2, растворимого в плазме. Согласно закону Генри, количество газа, растворенного в жид¬ кости, прямо пропорционально его парциальному давлению и коэффи¬ циенту растворимости. Растворимость О2 в плазме крови низка: при РО2 = = 1 мм рт.ст. в 100 мл крови растворяется 0,0031 мл О2
При нормальных физиологических условиях (РаО2 = 100 мм рт.ст.) в 100 мл крови растворяется 0,31 мл О2, т.е. 0,31 об.%. Такое количество О2 не обеспечивает потребности организма, поэтому основное значение име¬ ет другой способ переноса — в виде связи с гемоглобином внутри эритро¬ цита. Гемоглобин является основным протеином эритроцитов. Главной функцией гемоглобина является транспорт О2 от легких к тканям и транс¬ порт СО2 от тканей к легким. Каждая молекула гемоглобина человека со¬ стоит из белка глобина и гема. Основной глобин взрослых — НЬА являет¬ ся тетрамером, состоящим из двух полипептидных цепей а и двух поли¬ пептидных цепей р. В спиральную структуру каждой полипептидной цепи глобина встроен гем, который является комплексным соединением двух¬ валентного иона железа Fe2+ и порфирина. Ион железа гема способен присоединять одну молекулу О2, т.е. одна молекула гемоглобина способна связать 4 молекулы О2 Следует особо подчеркнуть уникальные особенно¬ сти иона Fe2+ тема обратимо связывать молекулу О2 НЬ + О2 НЬО2, в то время как обычно при реакции изолированного Fe2+ и кислорода обра¬ зуется Fe3+. Окисленный ион Fe3+ не способен высвобождать О2, т.е. об¬ разуется необратимая связь, а связь иона Fe2+ тема с О2 происходит за счет конформационных изменений третичной и четвертичной структуры глобина, она обратима, т.е. в тканях происходит высвобождение О2 Гемоглобин, связанный с четырьмя молекулами О2, называется оксигемоглобином, а гемоглобин, не содержащий О2или менее четырех молекул О2, — деоксигенированным гемоглобином. 1 г гемоглобина способен максимально связать 1,34 мл О2 Учитывая, что нормальное содержание гемоглобина составляет 15 г/100 мл, можно рассчитать, что в 100 мл крови максимально может содержаться 20.1 мл О2 связанного с гемоглобином. Данная величина называется кислородной емкостью крови (КЕК):
Наиболее важным параметром, определяющим количество кислорода, связанного с гемоглобином, является насыщение гемоглобина кислоро¬ дом — сатурация (SаО2), который рассчитывают по формуле:
При РаO2, равном 100 мм рт.ст., насыщение гемоглобина кислородом артериальной крови составляет около 97 %. В венозной крови (РО2 = 40 мм рт.ст.) SaO2 приблизительно равна 75 %.
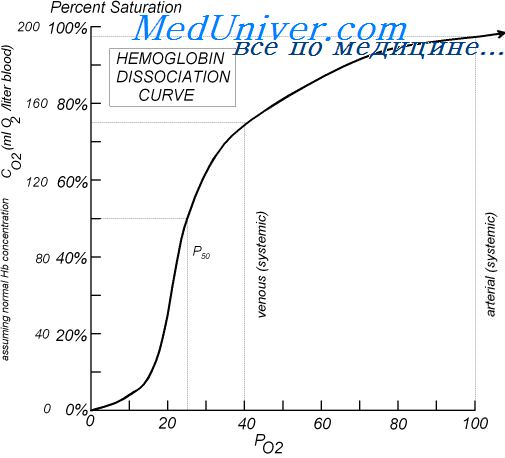
Кривая диссоциации оксигемоглобина Зависимость насыщения гемоглобина О2 от парциального напряжения О2 может быть представлена графически в виде кривой диссоциации окси¬ гемоглобина. Кривая имеет сигмовидную форму, при этом нижняя часть кривой (РаО2 60 мм рт.ст.) относительно пологая. Нижний участок кривой диссоциа¬ ции оксигемоглобина показывает, что при снижении РаО2 продолжается насыщение гемоглобина кислородом,т.е. ткани продолжают извлекать до¬ статочное количество О2 из крови. Верхняя пологая часть кривой демонст¬ рирует относительное постоянство насыщения гемоглобина кислородом, а следовательно, и содержания кислорода в крови независимо от изменений РаО2 (рис. 7.9).
Положение кривой диссоциации оксигемоглобина зависит от сродства гемоглобина с кислородом. При снижении сродства гемоглобина к О2, т.е. облегчении перехода О2 в ткани, кривая сдвигается вправо. Повышение сродства гемоглобина к О2 означает меньшее высвобождение кислорода в тканях, при этом кривая диссоциации сдвигается влево. Важным показате¬ лем, отражающем сдвиги кривой диссоциации оксигемоглобина, является параметр Р50, т.е. такое РО2, при котором гемоглобин насыщен кислоро¬ дом на 50 % (см. рис. 7.9). В нормальных условиях у человека (при t 37 °С, рН 7,40 и РаСО2= 40 мм рт.ст.) Р5о — 27 мм рт.ст. При сдвиге кривой дис¬ социации вправо Р50 увеличивается, а при сдвиге влево — снижается. На сродство гемоглобина к О2оказывают влияние большое количество метаболических факторов, к числу которых относятся рН, РСО2 темпера¬ тура, концентрация в эритроцитах 2,3-дифосфоглицерата (2,3-ДФГ). Сни¬ жение рН, повышение РСО2 и температуры снижают сродство гемоглоби¬ на к О2 и смещению кривой вправо. Такие метаболические условия созда¬ ются в работающих мышцах, и такой сдвиг кривой является физиологиче¬ ски выгодным, так как повышенное высвобождение О2необходимо для активной мышечной работы. В противоположность этому повышение рН, снижение температуры и снижение РСО2(такие условиях создаются в лег¬ ких) смещают кривую диссоциации оксигемоглобина влево (рис. 7.10).
Влияние рН и РаСО2 на кривую диссоциации называется эффектом Бора. 2,3-ДФГ образуется в эритроцитах в процессе гликолиза и выполняет функцию главного энергетического субстрата (в эритроцитах отсутствуют митохондрии, поэтому не происходят реакции окислительного фосфорилирования, и АТФ не имеет большого значения как источник энергии). В условиях продолжительной гипоксии увеличивается содержание 2,3-ДФГ в эритроцитах, что приводит к снижению сродства гемоглобина к O2 и более интенсивному переходу его из крови в ткани. Снижение концентра¬ ции 2,3-ДФГ в эритроцитах приводит к сдвигу кривой диссоциации влево. На кривую диссоциации оксигемоглобина может оказать влияние и окись углерода (СО). СО имеет сродство к гемоглобину в 240 раз выше, чем О2, и, связываясь с гемоглобином, образует карбоксигемоглобин (НЬСО). При этом даже небольшие количества СО могут связать большую часть НЬ крови и значительно уменьшить содержание О2 крови. Кроме того, СО сдвигает кривую диссоциации влево, что препятствует высвобож¬ дению О2 в тканях и также усугубляет гипоксию. Еще одним фактором, влияющим на сродство НЬ к кислороду, является метгемоглобин — гемоглобин, содержащий железо, окисленное до Fе3+. У здорового человека общее содержание метгемоглобина не превышает 3 %, однако при приеме некоторых лекарств (например, фенацетин, суль¬ фаниламиды, нитроглицерин) и дефиците фермента метгемоглобин-редуктазы происходит образование значительных количеств метгемоглобина. Метгемоглобинемия вызывает смещение кривой диссоциации влево, т.е препятствует высвобождению в тканях, а при повышении концентрации метгемоглобина более 60 % происходит также и уменьшение нормального НЬ, что приводит к тяжелой гипоксии.
источник
Смещение кривой диссоциации гемоглобина
Рис. 1.7. Кривая диссоциации оксигемоглобина.
Нормальному уровню Ра02 (92-98 мм рт. ст.) соответствует S ,0; 94-98 %. Добиться полного насыщения гемоглобина кислородом можно только посредством увеличения содержания кислорода во вдыхаемом газе.»
Выбирая пульсоксиметр, обычно проверяют его на себе. Если монитор показывает Sp О2= 100 % (а такие модели-оптимисты встречаются достаточно часто), подумайте, стоит ли его покупать. Испытывать пульсоксиметр должен некурящий человек, так как после выкуренной сигареты до 8-10 % гемоглобина крови превращаются в карбоксигемоглобин. При этом пульсоксиметр завышает Sa02, и модель может оказаться незаслуженно скомпрометированной.
Зависимость SaO 2 от РaО2 для каждого больного можно описать эмпирическими формулами (уравнение Хилла, алгоритмы Кел-мана, Северингхауза и др.), в которых учитываются температура, рН и прочие факторы. Данные формулы в разных модификациях обычно вводят в современные автоматические приборы контроля КЩС и газового состава крови ( Radiometer , AVL , Instrumentation Laboratories и пр.), которые вычисляют сатурацию гемоглобина по напряжению кислорода в крови. Собственно, сама кривая диссоциации оксигемоглобина и является графическим выражением этих уравнений. Более простой показатель положения кривой диссоциации — индекс Рм; он равен напряжению кислорода в крови, при котором сатурация гемоглобина составляет 50 % (рис. 1.7).
Нормальная величина P 50 равна 27 мм рт. ст. Ее уменьшение соответствует сдвигу кривой влево, а увеличение — сдвигу вправо.
После полного насыщения гемоглобина кислородом дальнейшее повышение Ра02 сопровождается лишь незначительным приростом СаО2 за счет физически растворенного кислорода. Поэтому увеличение концентрации кислорода во вдыхаемом или вдуваемом газе ( F 1 O 2) сверх уровня, достаточного для полного насыщения гемоглобиновой емкости ( Sa 02 = 99-100 %), редко бывает оправданным.
Проходя через капилляры, артериальная кровь отдает тканям часть содержащегося в ней кислорода и превращается в венозную ( PvO 2 = 40 мм рт. ст., SvO 2 = 75 %). Таким образом, в газообмене участвует лишь около 25 % запаса кислорода артериальной крови, а сатурация и десатурация гемоглобина происходят, на пологом участке кривой диссоциации.
Патология дыхательной системы приводит к нарушению ок-сигенации крови в легких с развитием артериальной гипоксемии, степень которой количественно оценивается пульсоксиметром. В этих условиях снабжение тканей кислородом осуществляется в «аварийном» режиме, на крутом участке кривой, где незначительного падения РаО2 оказывается достаточно для отделения от оксигемоглобина требуемого количества кислорода. Аварийность режима заключается в уменьшении напряжения и, следовательно, содержания кислорода в тканях, о чем свидетельствует низкое напряжение кислорода в венозной крови.
Гемоглобин как транспортный белок призван решать две задачи: присоединять кислород в легких и отдавать его тканям. Эти задачи противоположны по своей сути, но выполняются одним и тем же веществом, поэтому стремление гемоглобина связываться с кислородом (сродство гемоглобина к кислороду) должно быть достаточным — чтобы обеспечить оксигенацию крови в легких, но не избыточным — чтобы не нарушить процесс отдачи кислорода на периферии. Нормальное положение кривой диссоциации оксигемоглобина как раз и соответствует оптимальной готовности гемоглобина к реализации обеих задач. Но при определенных условиях баланс между стремлением гемоглобина присоединить кислород и готовностью его отдать нарушается. Графически это выражается сдвигом кривой диссоциации вправо или влево (рис. 1.8).
Рис. 1.8. Сдвиг кривой диссоциации оксигемоглобина.
При ацидозе (респираторном или метаболическом), гипертермии и увеличении концентрации 2,3-дифосфоглицерата (2,3-ДФГ) в эритроцитах сродство гемоглобина к кислороду снижается и кривая диссоциации НЬО2 сдвигается вправо. При этом насыщение гемоглобина кислородом в легких ухудшается (уменьшение Sp02 при прежнем РаО2), но отделение кислорода от оксигемоглобина в капиллярах облегчается.
Если газообмен в легких не нарушен, то даже существенный сдвиг кривой диссоциации вправо сопровождается весьма незначительным снижением Sp02, поскольку события в легких происходят на пологом участке кривой. В тканях же напряжение кислорода повышается. В отношении кислородного гомеостаза это в целом безопасная ситуация. Некоторые специалисты даже счи-
тают, что при нормальной работе легких ацидоз способствует снабжению тканей кислородом.
Иная картина наблюдается при грубой патологии дыхания, когда от легких оттекает кровь с низким напряжением кислорода, соответствующим крутому участку кривой диссоциации НЬО2. Если при этом кривая сдвинута вправо, SpO 2 может оказаться намного ниже, чем при нормальном положении кривой. Данное обстоятельство — дополнительный удар по снабжению тканей кислородом и важный вклад в дело развития гипоксии. Таким образом, при исходной артериальной гипоксемии (низком уровне РаС>2) метаболический ацидоз, гиперкапния и гипер-термия способны заметно снизить сатурацию гемоглобина (Sp02) и, следовательно, содержание кислорода в артериальной крови.
Алкалоз (респираторный или метаболический), гипотермия и уменьшение концентрации 2,3-ДФГ повышают сродство гемоглобина к кислороду, и кривая диссоциации НЬ02 сдвигается влево. В этих условиях гемоглобин жадно присоединяет к себе кислород в легких ( SpO 2 возрастает при прежнем РаО2) и неохотно отдает его тканям. Считается, что сдвиг кривой диссоциации влево всегда неблагоприятно сказывается на оксигенации тканей, ибо небольшой прирост содержания (но не напряжения) кислорода в артериальной крови не окупает последующего нежелания оксигемоглобина делиться кислородом с тканями на периферии. Пожалуй, от левого положения кривой диссоциации НЬО2 не страдают только новорожденные. Но это отдельная тема.
Непостоянство отношений между РаО2 и SpO 2 может затруднить осмысление данных пульсоксиметрии: далеко не всегда известно, по какой кривой диссоциации работает гемоглобин в данный момент.
источник
Кривая диссоциации оксигемоглобина
Этот график – кривая диссоциации оксигемоглобина, или сатурационная кривая, показывает, какая доля гемоглобина в данной крови связана с О2 при том или ином его парциальном давлении, а какая – диссоциирована, т.е. свободна от кислорода. КДО имеет S-образную форму. S-образный вид КДО указывает на кооперативный характер взаимодействия О2 с Hb. При соединении или отдаче одной молекулы О2 отмечаются функциональные изменения остальных субъединиц Hb в тетрамере.Такая её конфигурация, имеет определенный физиологический смысл, заключающийся в том, что оксигенация крови в легких сохраняется на высоком уровне даже при относительно низком альвеолярном pO2, а её деоксигенация существенно изменяется даже при небольшом изменении капиллярно-тканевого градиента pO2. Плато кривой характерно для сатурированной О2 (насыщенной) артериальной крови, а крутая нисходящая часть кривой – венозной, или десатурированной крови в тканях (рис. 2.4.).
В качестве показателя CГK принимается значение pО2, при котором Hb наполовину насыщается О2, обозначаемая p50, равна 26-28 мм рт.ст. При повышении СГК p50 уменьшается, а при снижении — повышается. Традиционно полагают, что сдвиг КДО вправо повышает отдачу кровью кислорода тканям, а влево затрудняет десатурацию крови в микроциркулярном русле.
На кривой выделяют 3 участка: от 0 до 10 мм рт. ст. — прямо пропорциональная зависимость, от 10 до 50 — насыщение очень быстрое, от 60 до 90 — насыщение почти не изменяется. При рО2 в артериальной крови, равном 96 мм рт. ст., % насыщения гемоглобина кислородом составляет 97%, а в венозной крови с рО2, равным 40 мм рт. ст., % насыщения гемоглобина равен 75%.
Значение S-образной формы кривой:
1) Крутой наклон среднего участка, соответствующий напряжениям О2 в тканях (35 мм рт. ст. и ниже), благоприятствует отдаче О2 в них.
2) Пологая часть, КДО соответствующая высоким напряжениям О2, обеспечивает стабильность тканевого рО2в условиях, когда рО2 артериальной крови может уменьшаться: при подъеме в горы или на самолете, при заболеваниях легких, с возрастом. Даже когда альвеолярное рО2 снижается до 60 мм рт. ст., гемоглобин в артериальной крови все еще насыщен О2 на 89%, что только на 8% ниже нормальной 97% сатурации.
3) С другой стороны, когда альвеолярное рО2 увеличивается до 500 мм рт. ст. (при вдыхании воздуха под повышенным давлением, например, на глубине моря или в компрессионных камерах), насыщение гемоглобина кислородом также изменяется мало – максимум на 3%.
Следовательно, при варьировании альвеолярного рО2 от 60 до 500 мм рт. ст. рО2 в тканях изменяется только на несколько мм рт. ст., т.е. гемоглобин буферирует сдвиги тканевого рО2.
В настоящее время принято оценивать положение КДО не по наклону кривой, а по расположению на ней двух точек. Первая соответствует 50%-ному насыщению гемоглобина кислородом – Р50 — напряжение полунасыщения (точка разрядки по Крогу). В норме при рН = 7,4 и t = 37 о С, Р50 артериальной крови 26 мм рт. ст. (3,46 кПа). Оно выше у женщин, чем у мужчин. Напряжение разрядки достаточно высоко, что обеспечивает эффективный градиент рО2 между капиллярами и тканями, где рО2 не более 10-15 мм рт.ст. Вторая точка соответствует 95%-ному насыщению гемоглобина кислородом — Р97 — точка зарядки. В норме Р97 артериальной крови 70 мм рт. ст.
КДО может занимать различное положение, характеризующееся смещением ее средней части вправо или влево (рис.2.5. ).
Сдвиги кривой диссоциации
Традиционно полагают, что сдвиг КДО вправо повышает отдачу кровью кислорода тканям, а влево затрудняет десатурацию крови в микроциркулярном русле.
Смещение влево сопровождается снижением Р50 и повышением сродства гемоглобина к О2 (СГК), а вправо — увеличением Р50 и уменьшением СГК.
Сродство кислорода к гемоглобину и способность отдавать О2 в тканях зависит от метаболических потребностей клеток организма и регулируется важнейшими факторами метаболизма тканей, вызывающими смещение кривой диссоциации(рис.2.6.). К этим факторам относятся: концентрация водородных ионов, температура, парциальное напряжение углекислоты и соединение, которое накапливается в эритроцитах – это 2,3-дифосфоглицератфосфат (ДФГ).
Факторы, влияющие на СГК.
По механизму действия их делят на 2 группы: прямые и косвенные.
Прямое влияние оказывают химические вещества, которые могут взаимодействовать с гемоглобином и изменять конформацию его молекулы. Это лиганды (О2, Н + , СО2, органические и неорганические соли).
Косвенное действие оказывают физические факторы (t о , pH), которые изменяют условия взаимодействия Hb с лигандами.
Рассмотрим первую группу факторов:
I. В 1907 C.Bohru, A.Krogh установили зависимость положения КДО от содержания СО2 в крови. Сначала “эффект Бора” связывали только с СО2. Однако затем J.Barcroft (1909) показал, что подобная связь существует и при воздействии других кислот. В настоящее время эффект Бора рассматривается как влияние рН среды на взаимодействие атома Fe 2+ с различными лигандами.
При снижении рН (увеличении [Н + ]) СГК падает. Поэтому КДО смещается вправо. Уменьшение оксигенации Hb при снижении рН — эффект Рута.
Описанные эффекты объясняются тем, что при изменении рН происходит сдвиг константы диссоциации и конформации групп, связанных с О2 в тетрамере гемоглобина. В результате этого меняется СГК. Различают респираторный и метаболический компоненты эффекта Бора.
Метаболический — связан с изменением рН под влиянием кислых или щелочных продуктов обмена веществ.
Респираторный — связан с влиянием СО2 на КДО. Образующийся при тканевом метаболизме СО2 диффундирует внутрь эритроцитов, где под влиянием карбоангидразы образуется Н2СО3 = Н + + НСО3 ־ . Образующиеся при ее диссоциации Н + приводят к снижению рН. Это рН-зависимый эффект СО2. Однако СО2 также образует карбаминовые связи с концевыми группами a и b цепей гемоглобина, способствуя таким образом стабилизации дезоксиформы гемоглобина. Это рН-независимый эффект СО2.
На выраженность эффекта Бора влияют:
1) органические фосфаты — при повышении содержания 2,3-дифосфоглицериновой кислоты (2,3-ДФГ) падает коэффициент Бора, который определяют как D log Р50 / D log рН; 2) температура; 3) насыщение крови О2;
4) электролиты; 5) свойства Hb; 6) пол — коэффициент Бора меньше у мужчин, чем у женщин.
Т.о., эффект Бора — это результат сложного взаимодействия рН, СО2, 2,3-ДФГ и всех других указанных факторов.
Биологический смысл эффекта Бора: он способствует поглощению О2 в легких и отдаче его в тканях.
В легких — поглощение О2 идет одновременно с выделением СО2, поэтому по мере насыщения гемоглобина кислородом КДО сдвигается влево (рис. 2.6), т.е. СГК возрастает. В результате скорость диффузии О2 из альвеол в кровь несколько увеличивается.
В тканях — одновременно с выходом О2 в эритроциты поступает СО2, поэтому КДО смещается вправо, что приводит к снижению СГК и благоприятствует отдаче О2 тканям.
II. В 1967 г. была описана специфическая роль органичнских фосфатов в эритроцитах. 2,3-ДФГ, значительно уступая АТФ в энергетической ценности, играет огромную роль в регуляции транспорта О2. Во-первых, он взаимодействует с b-цепями восстановленного гемоглобина благодаря соответствию зарядов некоторых аминокислотных остатков распределению зарядов в органическом фосфате. После образования связи с b-цепью 2,3-ДФГ закрывает вход в центральный канал молекулы, что уменьшает СГК. Во-вторых, 2,3-ДФГ также изменяет внутриклеточный рН.
На реакцию 2,3-ДФГ и гемоглобина влияют:
1) соотношение Hb/HbО2 — чем оно выше, тем больше связывается 2,3-ДФГ);
2) рН — снижение рН увеличивает сродство гемоглобина к 2,3-ДФГ;
3) рСО2 — уменьшение рСО2 повышает сродство гемоглобина к 2,3-ДФГ;
4) t о — возрастание t о препятствует присоединению 2,3-ДФГ к гемоглобину;
5) анионы — могут конкурировать с 2,3-ДФГ за одни и те же центры связывания.
С изменением содержания 2,3-ДФГв эритроцитах связана зависимость СГК от их возраста — молодые эритроциты имеют меньшее СГК, по мере старения оно возрастает, поскольку уровень 2,3-ДФГ уменьшается.
Роль 2,3-ДФГ в качестве регулятора положения КДО заключается не только во влияниии на СГК. Он служит посредником других влияний — рН, рСО2, t, ионного состава на кислородтранспортную функцию крови.
III. Органические и неорганические соли — при увеличении их концентрации КДО сдвигается вправо. Соли влияют через эритроцитарный метаболизм.
К косвенным факторам, как уже отмечалось, относят рН, влияние которого на СГК рассмотрено выше, и t о . Уменьшение t о увеличивает интенсивность образования HbО2, т.е. при прочих равных условиях смещает КДО влево. Повышение t о , напротив, снижает СГК.
Температурный коэффициент, представляющий собой отношение D log рО2 / D t о , зависит от рН, [2,3-ДФГ], насыщения крови кислородом. Он различен у мужчин и женщин. Оксигенация гемоглобина является экзотермической реакцией, соответственно диссоциация оксигемоглобина протекает с поглощением тепла. При повышении температуры крови происходит снижение СГК и его увеличение при снижении температуры. Алкалоз и гипотермия повышают сродство гемоглобина к кислороду. В этих условиях гемоглобин жадно присоединяет к себе кислород в легких и неохотно отдает его тканям.
При ацидозе и гипертермии в эритроцитах сродство гемоглобина к кислороду снижается. При этом насыщение гемоглобина кислородом в легких ухудшается, но отделение кислорода от оксигемоглобина в капиллярах облегчается.
Особый интерес для изучения кислородсвязывающих свойств крови представляет выделение NO клетками эндотелия кровеносных сосудов.
В целом, дыхательный цикл можно рассматривать как механизм транспорта «трех газов»: NO/О2/CО2 . Характерной особенностью NO является способность быстро (менее чем за 5 секунд) диффундировать через мембрану синтезировавшей его клетки в межклеточное пространство и легко (без участия рецепторов) проникать в клетки-мишени. В результате взаимодействия NO и гемоглобина происходит образование его различных NO-форм: метгемоглобин, нитрозилгемоглобин, нитрозогемоглобин, которые играют роль своеобразного аллостерического регулятора функциональной активности гемоглобина на уровне отдельных его тетрамеров. Присутствие этих соединений гемоглобина с NO может по-разному влиять на СГК всей крови: метгемоглобин и нитрозогемоглобин его повышают, а нитрозилгемоглобин снижает. В ходе одного цикла движения эритроцита в сосудистой системе происходят последовательные реакции гемоглобина с NO, модулирующиеся его структурными переходами из R— в Т-состояние. На уровне капилляров малого круга кровообращения это может быть дополнительным механизмом, способствующим оксигенации крови, а на уровне микроциркуляции большого круга – оптимизирующим десатурацию крови, и, соответственно, доставку кислорода в ткани.
Транспорт углекислого газа кровью
Химические реакции связывания СО2 несколько сложнее, чем О2. Это обусловлено тем, что механизмы, отвечающие за транспорт СО2, должны одновременно обеспечивать поддержание кислотно-щелочного равновесия крови и тем самым — внутренней среды организма.
I. Первый способ связывания СО2 — прежде всего происходит гидратация молекул СО2 с образованием Н2СО3
В плазме эта реакция протекает очень медленно. В эритроцитах она ускоряется в 20 тысяч раз, что связано с действием карбоангидразы — фермента, расположенного только внутри клеток. Его существование предполагал еще И.М.Сеченов, но открыт он был в 1932 г. Мелдрумом и Рафтоном.
Следующая реакция в цепи химических превращений СО2 заключается в диссоциации слабой кислоты Н2СО3 на бикарбонат-ионы и Н + .
Н2СО3 ® НСО3 ־ + Н +
Накопление НСО3 ־ в эритроцитах приводит к тому, что между его внутренней средой и плазмой крови создается градиент концентрации этого иона. НСО3 могут передвигаться по этому градиенту лишь в том случае, если при этом не будет нарушаться равновесное распределение электрических зарядов. Т.е., одновременно с выходом НСО ־ 3 должен происходить либо выход из эритроцитов одного катиона, либо вход одного аниона(рис.2.7.). Поскольку мембрана эритроцитов практически непроницаема для катионов, но проницаема для небольших анионов, взамен НСО3 в эритроциты поступает Cl — . Этот обменный процесс называется хлоридным сдвигом Хамбургера.
Участие эритроцитов в обмене О2 и СО2 в тканях и в легких
А- между тканями и кровью; Б- между кровью и альвеолярным воздухом
Накопление анионов внутри эритроцитов приводит к повышению осмотического давления, что вызывает поступление в них воды. В результате этого объем эритроцитов в венозной крови больше, чем в артериальной. Поэтому эритроциты занимают 40% объема артериальной крови и 40,4% — венозной. Образующиеся при реакции диссоциации Н2СО3 протоны не изменяют рН, поскольку гемоглобин, будучи амфолитом, обладает значительной буферной емкостью. Кроме того, восстановленный гемоглобин является более слабой кислотой, чем оксигемоглобин, поэтому может присоединять дополнительное количество Н + . В тканях Hb ведет себя как основание:
(HСО3 
II. Второй способ связывания СО2 — непосредственное его присоединение к аминогруппам белкового компонента гемоглобина за счет образования карбаминовой связи. В легких Hb выполняет функцию кислоты:
HbNH2 + CO2 ® HbNHCOO — + H +
Соединение гемоглобина с СО2 называется карбаминогемоглобином. На количество связываемого таким образом СО2 влияет оксигенация гемоглобина. Присоединение О2 к гемоглобину уменьшает количество связываемого в виде карбаминового соединения СО2.
Еще в 1892 г. Вериго было установлено, что газовая емкость по отношению к СО2 крови, содержащей восстановленный гемоглобин, значительно выше, чем в условиях полной оксигенации гемоглобина. Это явление, затем подробно изученное Холденом (1914), обусловлено тем, что, во-первых, оксигемоглобин является более сильной кислотой, чем восстановленный гемоглобин, и, следовательно, когда реакция происходит между КНbO2 и Н2СО3, равновесие наступает при образовании меньшего объема КНСО3, чем в случае, когда реакция течет между КНb и Н2СО3. Во-вторых, оксигенация гемоглобина ведет к снижению образования карбаминогемоглобина, поскольку уменьшает количество свободных NH2 групп глобина, способных связывать СО2. Следовательно, оксигенация гемоглобина влияет на способность крови связывать СО2. Это явление получило название эффекта Вериго-Холдена.
Соотношение между фракциями СО2 в крови. Каждый мл крови, протекая через ткани, захватывает примерно 2 мМоль СО2. 5-10% этого количества остается в физически растворенном виде, 10% образует карбаминовую связь с гемоглобином, 35% транспортируется в виде бикарбонатов в эритроцитах, а остальные 45% — в виде бикарбонатов натрия — в плазме. При прохождении крови через легкие СО2 выделяется из этих фракций точно в таком же соотношении.
Таким образом, дыхательная функция крови является важной составной частью функциональной системы транспорта газов и необходима для следующего этапа дыхания — газообмена между кровью и тканями.
Последнее изменение этой страницы: 2019-08-19; Нарушение авторского права страницы
источник