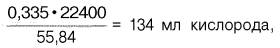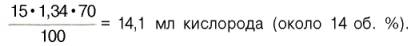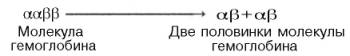ДЫХАТЕЛЬНАЯ ФУНКЦИЯ КРОВИ. Перенос кислорода кровью
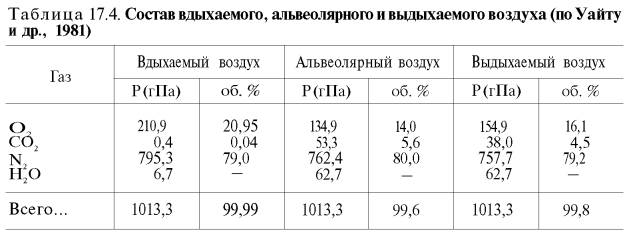
Сущность дыхательной функции крови состоит в доставке кислорода от легких к тканям и углекислого газа от тканей к легким (табл. 17.4).
Кровь осуществляет дыхательную функцию прежде всего благодаря наличию в ней гемоглобина. Физиологическая функция гемоглобина как переносчика кислорода основана на способности обратимо связывать кислород. Поэтому в легочных капиллярах происходит насыщение крови кислородом, а в тканевых капиллярах, где парциальное давление кислорода резко снижено, осуществляется отдача кислорода тканям.
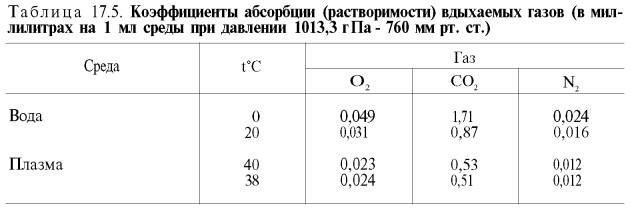
В состоянии покоя ткани и органы человека потребляют около 200 мл кислорода в минуту. При тяжелой физической работе количество потребляемого тканями кислорода возрастает в 10 раз и более (до 2–3 л/мин). Доставка от легких к тканям такого количества кислорода в виде газа, физически растворенного в плазме, невозможна вследствие малой растворимости кислорода в воде и плазме крови (табл. 17.5).
Исходя из приведенных в табл. 17.5 данных, а также зная РO2 в артериальной крови – 107–120 гПа (80–90 мм рт. ст.), нетрудно видеть, что количество физически растворенного кислорода в плазме крови не может превышать 0,3 об. %. При расчете кислородной емкости крови этой величиной можно пренебречь.
Итак, функцию переносчика кислорода в организме выполняет гемоглобин. Напомним, что молекула гемоглобина построена из 4 субъединиц (полипептидных цепей), каждая из которых связана с гемом (см. главу 2). Следовательно, молекула гемоглобина имеет 4 гема, к которым может присоединяться кислород, при этом гемоглобин переходит в оксигемо-глобин.
Гемоглобин человека содержит 0,335% железа. Каждый грамм-атом железа (55,84 г) в составе гемоглобина при полном насыщении кислородом связывает 1 грамм-молекулу кислорода (22400 мл). Таким образом, 100 г гемоглобина могут связывать
а каждый грамм гемоглобина – 1,34 мл кислорода. Содержание гемоглобина в крови здорового человека составляет 13–16%, т.е. в 100 мл крови 13–16 г гемоглобина. При РО2 в артериальной крови 107–120 гПа гемоглобин насыщен кислородом на 96%. Следовательно, в этих условиях 100 мл крови содержит 19–20 об. % кислорода:
В венозной крови в состоянии покоя РО2 = 53,3 гПа, и в этих условиях гемоглобин насыщен кислородом лишь на 70–72%, т.е. содержание кислорода в 100 мл венозной крови не превышает
Артериовенозная разница по кислороду будет около 6 об. %. Таким образом, за 1 мин ткани в состоянии покоя получают 200–240 мл кислорода (при условии, что минутный объем сердца в покое составляет 4 л).
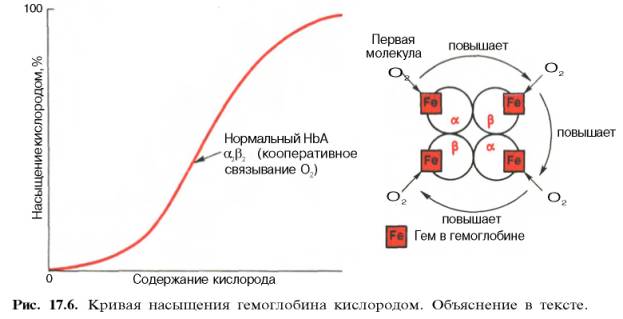
Возрастание интенсивности окислительных процессов в тканях, например при усиленной мышечной работе всегда связано с более полным извлечением кислорода из крови. Кроме того, при физической работе резко увеличивается скорость кровотока. Зависимость между степенью насыщения гемоглобина кислородом и РО2, можно выразить в виде кривой насыщения гемоглобина кислородом, или кривой диссоциации оксигемоглобина, которая имеет S-образную форму и характеризует сродство гемоглобина к кислороду (рис. 17.6).
Характерная для гемоглобина S-образная кривая насыщения кислородом свидетельствует, что связывание первой молекулы кислорода одним из
гемов гемоглобина облегчает связывание последующих молекул кислорода тремя другими оставшимися гемами. Долгое время механизм, лежащий в основе этого эффекта, оставался загадкой, так как, по данным рентгено-структурного анализа, 4 гема в молекуле гемоглобина довольно далеко отстоят друг от друга и вряд ли могут оказывать взаимное влияние. В последнее время принято следующее объяснение происхождения S-образ-ной кривой. Считают, что тетрамерная молекула гемоглобина способна обратимо распадаться на две половинки, каждая из которых содержит одну α-цепь и одну β-цепь:
При взаимодействии молекулы кислорода с одним из четырех гемов гемоглобина кислород присоединяется к одной из половинок молекулы гемоглобина (допустим, к α-цепи этой половинки). Как только такое присоединение произойдет, α-полипептидная цепь претерпевает конформа-ционные изменения, которые передаются на тесно связанную с ней β-цепь; последняя также подвергается конформационным сдвигам. β-Цепь присоединяет кислород, имея уже большее сродство к нему. Таким путем связывание одной молекулы кислорода благоприятствует связыванию второй молекулы (так называемое кооперативное взаимодействие).
После насыщения кислородом одной половины молекулы гемоглобина возникает новое, внутреннее, напряженное состояние молекулы гемоглобина, которое вынуждает и вторую половину гемоглобина изменить конфор-мацию. Теперь еще две молекулы кислорода, по-видимому, по очереди связываются со второй половинкой молекулы гемоглобина, образуя оксигемоглобин.
S-образная форма кривой насыщения гемоглобина кислородом имеет большое физиологическое значение. При такой форме кривой обеспечивается возможность насыщения крови кислородом при изменении РО2 в довольно широких пределах. Например, дыхательная функция крови существенно не нарушается при снижении РО2 в альвеолярном воздухе со 133,3 до 80–93,3 гПа. Поэтому подъем на высоту до 3,0–3,5 км над уровнем моря не сопровождается развитием выраженной гипоксемии.
Численно сродство гемоглобина к кислороду принято выражать величиной Р50 – парциальное напряжение кислорода, при котором 50% гемоглобина связано с кислородом (рН 7,4 температура 37°С). Нормальная величина Р50 около 34,67 гПа (см. рис. 17.6). Смещение кривой насыщения гемоглобина кислородом вправо означает уменьшение способности гемоглобина связывать кислород и, следовательно, сопровождается повышением Р50. Напротив, смещение кривой влево свидетельствует о повышенном сродстве гемоглобина к кислороду, величина Р50 снижена.
Ход кривой насыщения гемоглобина кислородом или диссоциации оксигемоглобина зависит от ряда факторов. Сродство гемоглобина к кислороду в первую очередь связано с рН. Чем ниже рН, тем меньше способность гемоглобина связывать кислород и тем выше Р50. В тканевых капиллярах рН ниже (поступает большое количество СО2), в связи с чем гемоглобин легко отдает кислород. В легких СО2 выделяется, рН повышается и гемоглобин активно присоединяет кислород.
Способность гемоглобина связывать кислород зависит также от температуры. Чем выше температура (в тканях температура выше, чем в легких), тем меньше сродство гемоглобина к кислороду. Напротив, снижение температуры вызывает обратные явления.
Количество гемоглобина в крови, а также в какой-то мере его способность связывать кислород (характер кривой диссоциации оксигемоглобина) несколько меняются с возрастом. Например, у новорожденных содержание гемоглобина доходит до 20–21% (вместо обычных для взрослого 13–16%). У человека имеется несколько гемоглобинов, которые образуются в различном количестве в разные стадии онтогенеза и различаются по своему сродству к кислороду.
Рассмотрим нарушения дыхательной функции крови при некоторых патологических состояниях.
источник
Перенос кислорода
Перенос кислорода
Для выживания человек должен быть способен поглощать кислород из атмосферы и транспортировать его клеткам, где он используется в метаболизме. Некоторые клетки могут короткое время вырабатывать небольшое количество энергии без участия кислорода (анаэробный метаболизм). Другие органы (например, головной мозг) состоят из клеток, которые могут существовать только при наличии постоянного снабжения кислородом (аэробный метаболизм). Различные ткани имеют различную степень толерантности к аноксии (отсутствию кислорода). Мозг и сердце — наиболее уязвимые органы. В начале недостаток кислорода поражает функцию органа, а с течением времени вызывает и необратимые морфологические изменения (в случае с мозгом это происходит в течение считанных минут), когда восстановление функции невозможно.
В покое клетки нашего тела потребляют около 300 л кислорода в сутки, или 250 мл в минуту. При физических упражнениях илиработе потребность в нем может возрасти в 10—15 раз. Если бы кислород, приносимый кровью тканям, был просто растворен в плазме, крови нужно было бы циркулировать в организме, даже находящемся в состоянии покоя, со скоростью 180 л в минуту, чтобы доставить достаточное количество этого газа клеткам, так как кислород не особенно хорошо растворим в плазме. В действительности, когда человек отдыхает, кровь циркулирует в его сосудах со скоростью около 5 л в минуту и переносит весь кислород, необходимый клеткам. Разница между 180 и 5 л в минуту обусловлена функцией гемоглобина.
Гемоглобин — это пигмент красных кровяных клеток, осуществляющий перенос почти всего кислорода и большей части углекислоты. Кровь, находящаяся в равновесии с альвеолярным воздухом, находящимся в легких, может содержать в растворе только 0,25 мл кислорода и 2,7 дл углекислоты на 100 мл, но благодаря гемоглобину 100 мл крови могут нести около 20 мл кислорода и 50—60 мл углекислоты.
Примерно 2% кислорода крови растворено в плазме, остальное же количество находится в соединении с гемоглобином. После того как кислород входит в кровь легочных капилляров, он диффундирует из плазмы в эритроциты и соединяется с гемоглобином — одна молекула кислорода присоединяется к одной молекуле гемоглобина с образованием молекулы оксигемоглобина.
Стрелки показывают, что эта реакция обратима, т. е. она может идти в любом направлении в зависимости от условий. Гемоглобин, разумеется, приносил бы организму мало пользы, если бы он мог только принимать кислород, но не отдавал бы его там, где это необходимо. В легких реакция идет слева направо, с образованием оксигемоглобина, а в тканях — справа налево, с освобождением кислорода . Различный цвет артериальной и венозной крови обусловлен тем, что оксигемоглобин имеет ярко-красную окраску, а гемоглобин — пурпурную . Соединение кислорода с гемоглобином и расщепление оксигемоглобина регулируется двумя факторами: прежде всего количеством присутствующего кислорода и в меньшей степени — количеством углекислоты . В легких концентрация кислорода относительно высока, и там образуется оксигемоглобин. Выйдя из легких, кровь проходит через сердце и артерии, где концентрация кислорода почти не меняется, к тканям, которые бедны кислородом. Здесь оксигемоглобин расщепляется, освобождая кислород, который диффундирует в тканевые клетки.
Углекислота, соединяясь с водой, образует угольную кислоту Н2С03; поэтому при повышении концентрации С02 кислотность крови возрастает . Способность гемоглобина переносить кислород при этом уменьшается; таким образом, соединение гемоглобина с кислородом отчасти регулируется количеством С02. Это создает чрезвычайно эффективную систему переноса. В капиллярах тканей концентрация углекислоты высока; действие низкого напряжения 02 в сочетании с действием высокого напряжения С02 ведет к освобождению кислорода гемоглобином. В капиллярах легких (или жабр у рыб) напряжение С02 ниже, и под действием высокого напряжения 02 и низкого напряжения С02 гемоглобин присоединяет к себе кислород. Важно помнить, что чем больше в крови углекислоты, тем более кислую реакцию имеет кровь, а в кислом растворе способность гемоглобина переносить кислород понижена.
Направление и скорость диффузии фактически определяются парциальным давлением, или напряжением, данного газа . В газовой смеси каждый газ производит независимо от остальных газов то же самое давление, которое он создавал бы один. На уровне моря, где общее давление воздуха равно 760 мм рт. ст., кислород создает давление 150 мм рт. ст . Иными словами, парциальное давление (напряжение) кислорода в атмосфере равно 150 мм рт. ст. Так как в альвеолярном воздухе кислорода меньше, чем в атмосферном, то парциальное давление кислородав альвеолах составляет около 105 мм рт . ст . Кровь проходит через легочные капилляры слишком быстро, чтобы прийти в полное равновесие с альвеолярным воздухом, так что давление кислородав артериальной крови несколько ниже -около 100 мм рт. ст.Парциальное давление кислорода в тканях колеблется от 0 до 40 мм рт ст., поэтому кислород диффундирует из капилляров в ткани .Однако из крови выходит не весь кислород, кровь протекает через капилляры слишком быстро, чтобы могло быть достигнуто полное равновесие, и кроме того ткани обычно содержат остаточный кислород. В венозной крови, возвращающейся к легким, давление кислорода равно около 40 мм рт. ст. В артериальной крови, где парциальное давление кислорода равно обычно 100 мм рт.ст., на каждые 100 мл крови приходится около 19 мл кислорода. При напряжении 02, свойственном венозной крови (40 мм рт. ст.), в каждых 100 мл крови содержится 12 мл кислорода. Разность в 7 мл представляет количество кислорода, отданное тканям каждыми 100 мл крови . Таким образом, 5 л крови нашего тела за каждый кругооборот по организму могут передавать тканям 350 мл кислорода.
источник
Большая Энциклопедия Нефти и Газа
Способность — гемоглобин
Способность гемоглобина связывать кислород зависит также от температуры. [1]
Способность гемоглобина связывать кислород зависит от ряда факторов. В тканях, где значение рН несколько меньшее по сравнению с легкими, а концентрация С02 достаточно высока, сродство гемоглобина к кислороду снижается, кислород отделяется, а С02 и протон водорода присоединяются к гемоглобину. Этот феномен называется эффектом Бора в честь ученого, впервые открывшего это явление. В реализации данного эффекта кроме гемоглобина и кислорода участвуют С02 и протон водорода. Дезоксигемоглобин представляет собой прото-нированную форму пигмента. [3]
Так как способность гемоглобина переносить кислород с понижением рН падает, то ацидоз — это вопрос жизни и смерти. [4]
Реакция обусловлена способностью гемоглобина катализировать окисление гваяковой смоляной кислоты перекисью водорода в озонид гваяковой кислоты синего цвета. [5]
При ацидозе это равновесие смещается влево и способность гемоглобина образовывать окси-гемоглобин НЬО2 уменьшается. [7]
Когда давление Рао2 падает ниже 60 мм рт.ст., способность гемоглобина переносить кислород ( О2 на % насыщения) резко снижается. [9]
Оксид углерода ( СО) является бесцветным газом без запаха, который снижает способность гемоглобина переносить и поставлять кислород. [10]
Интересно, что в животных организмах кобальт вызывает не только повышение содержания гемоглобина, но и некоторое снижение способности гемоглобина поглощать кислород. Это объясняется частичной заменой железа в гемоглобине на кобальт. [11]
Угарный газ является газом с высокой проникающей способностью, который может оказывать некоторое, возможно фатальное, влияние на способность гемоглобина к переносу кислорода. [12]
Монооксид углерода является опасным загрязнителем атмосферы. Он снижает способность гемоглобина крови к переносу кислорода, вызывает появление и развитие сердечных недугов, уменьшает активность работы мозга. Особенно чувствительны к отравлению СО молодые люди и беременные женщины. [13]
При соединении гемоглобина с кислородом меняются не только свойства простетической группы, но и физические и химические свойства молекулы в целом. Ранее уже указывалось, что способность гемоглобина присоединять основания увеличивается при переходе гемоглобина в оксигемоглобин. Следствием этого является то, что артериальная и венозная кровь имеет почти одинаковую реакцию. Более высокое содержание угольной кислоты в венозной крови компенсируется более высокой кислотностью оксигемоглобина артериальной крови. Кривая образования оксигемоглобина в зависимости от давления кислорода [153] характеризуется особой, необычной для подобных процессов, сигмо-образной формой ( фиг. [14]
Хотя гемоглобин при высоком давлении кислорода почти так же хорошо связывает его, как и миоглобин, при низких давлениях он связывает 02 значительно хуже миоглобина и поэтому передает его миоглобину в мышцах, как это и нужно. Диоксид углерода понижает рН, а это еще больше увеличивает способность гемоглобина передавать кислород миоглобину. Влияние рЙ, так называемый эффект Бора, а также прогрессивное увеличение констант связывания кислородд в гемоглобине обусловлены специфическими взаимодействиями между субъединицами. Миоглобин ведет себя проще, поскольку он состоит только из одной субъединицы. [15]
источник
Путь кислорода в теле. Прием гемоглобином кислорода
В предыдущей статье мы рассмотрели, как кислород прошел альвеолярно-капиллярную мембрану и проник в кровеносный сосуд. Здесь он встречается с гемоглобином, который должен транспортировать его к клеткам. Читайте последовательно, или переходите по ссылкам.
И ВОТ О2 ПРОНИКАЕТ В КРОВЬ..
Часть II. Транспорт кислорода.
Гемоглобин
У крови много функций. Главная из них — перенос кислорода. Доставить весь кислород от легких к тканям в виде физически растворенного газа в крови невозможно — в плазме крови растворяется всего 3 %, так как кислород почти не растворяем в плазме и воде [ 1 ]. Поэтому для его транспортировки организм выделяет специфический белок крови — гемоглобин (Hb).
Гемоглобин находится в красных кровяных клетках, которые на греческом языке называются «эритроциты». Общая поверхность всех циркулирующих в крови эритроцитов 3800 м 2 .
Количество физически растворенного в крови кислорода мало и не играет значимой роли в его транспорте: при paO2 100 мм рт. ст. в литре крови O2 растворено всего 3,1 мл/л (СO2 – 45 мл/л). Если бы гемоглобина не существовало, адекватная доставка кислорода была бы возможной лишь при сердечном выбросе, превышающем 120 л/мин! [ 2 ] Однако эти 3 % важны, поскольку кислород из альвеол в кровь и эритроцит, и из капилляров к тканям проходит через физическое растворение.
Основное количество O2 переносится в связанном с гемоглобином виде.
Связывание кислорода гемоглобином (Нb + O2 = НbO2) происходит в капиллярах легких. В основном это получается за счет высокого парциального давления О2 в альвеолах (100 мм рт. ст.). Скорость прохождения крови в капиллярах легких, в среднем, составляет 0,5 с, но скорость оксигенации еще быстрей — всего 0,01 с.
Степень нормального насыщения кислородом артериальной крови 98 – 100 %. Но бывает и так, что кислородная емкость крови слишком мала. Тогда говорят о малокровии (анемии). Причина — нехватка эритроцитов в крови, или недостаток гемоглобина в эритроците. Это ситуация, когда желающих «сесть на поезд» много, а вагонов или мест в них мало.
Недостаток эритроцитов в крови
Причин недостаточного количества эритроцитов в крови может быть множество:
· Недостаточное образование эритроцитов — дефицит белка, железа, фолиевой кислоты, витамина B12 и др. Дефицит может быть при недостаточном поступлении с пищей или при нарушении их усвоением желудком и кишечником.
В каждой молекуле гемоглобина 4 атома железа, а всего его в организме около 4,5 г. За сутки мужчины теряют около 1 мг железа, а женщины — до 3 мг. В период менструаций потери возрастают до 14 мг. В период беременности потери составляют в сумме 700-800 мг, а за весь период лактации — 400 мг. Поэтому и мужчинам, и, особенно, женщинам, необходима постоянная компенсация железа.
· Дефицит железа в пище или низкая его усвояемость приводят к развитию железодефицитной анемии. Она часто встречается у женщин при беременности. При этом снижаются цветовой показатель ниже 0,8, уровень эритроцитов — ниже 3,6×1012/л, гемоглобин — ниже 110 г/л. [ 3 ];
· Разрушение эритроцитов раньше срока. В норме срок жизни эритроцита 120 дней. Инфекции, вирусы и грибки сокращают срок его службы (см. ниже);
· Беременность. Эстрогены тормозят эритропоэз, поэтому в период беременности уровень эритроцитов часто снижен (присутствует анемия) [ 4 ];
· Наследственное генетическое заболевание крови;
· Кровопотеря. Количество эритроцитов в крови сокращается в результате острой или хронической кровопотери – ранения, кровоточащая язва желудка, геморроидальные узлы и др.;
· Прием некоторых препаратов. Например, фенобарбитал является частью популярных сердечных и успокоительных средств (корвалол и др.). При частом использовании может привести к эритропении. Неблагоприятное воздействие на эритроциты оказывает химиотерапия.
Недостаток гемоглобина в эритроцитах
Теперь рассмотрим ситуацию, когда в крови достаточно эритроцитов, но концентрация общего гемоглобина ниже нормы.
В одном эритроците 270 миллионов молекул гемоглобина. Если микроскоп показывает мембраны эритроцитов однородной окраски — в них 100 % содержание гемоглобина. Но очень часто можно встретить внутри эритроцита белое кольцо, которое лишь снаружи окрашено в розовый цвет — в нем гемоглобина всего 50-60 %, то есть меньше чем у здорового эритроцита. Если таких эритроцитов будет более 30 %, показатель общего гемоглобина снижается, и врачи ставят диагноз анемия.
Люди, страдающие анемией бледны, словно им и в самом деле не хватает крови. При недостатке гемоглобина кровь несет тканям недостаточное количество кислорода и в них возникает гипоксия. В результате производится меньше энергии, и люди быстрее устают.
Почему не хватает гемоглобина в эритроцитах?
· Гемоглобин это белок. Дефицит белка означает, что у этого человека в рационе питания мало качественного белка.
· Агрессия вирусами, грибками, паразитами и прочими простейшими. При осмотре через микроскоп, на это указывают неровные края мембраны эритроцита, что указывает на его повреждение. Еще можно увидеть, как к мембране эритроцита прикрепляются нитиевидные образования, которые используют его как сырьевую базу. Гемоглобин едят грибки, вирусы и паразиты, они любят его, он для них он важен. [ 5 ]
· Молекула гемоглобина состоит из 514 аминокислот, из которых 7 в организме не синтезируются. Они должны поступить в наше тело только с едой. Обзор необходимых аминокислот для высокого гемоглобина см. здесь.
· Некоторые люди по наследству через гены получают заболевание крови — гемоглобиноз, при котором гемоглобин имеет низкую способность транспортировать кислород.
Бывает и обратная ситуация, при которой в крови образуется слишком большое количество эритроцитов. Это состояние называется полицитемией (от греч. «много клеток в крови»). Слишком много эритроцитов сгущает кровь, делает ее более вязкой. Это препятствует нормальной циркуляции крови и насыщению кислородом тканей.
Когда человек живет высоко в горах, полицитемия только желательна, но на уровне моря она может стать опасной. Поэтому спускающиеся с гор люди проходят акклиматизацию, как и равнинный житель в горах, только здесь наоборот.
Дисгемоглобин
Осталось рассмотреть еще одну ситуацию, которая может помешать кислороду зайти в эритроцит. Это тот случай, когда поезда в расписании есть, билет куплен, но увы, место занято другим пассажиром.
Гемоглобин собирает исключительно молекулы кислорода («на этом поезде места для тех кто купил билеты»). Однако некоторые газы могут этому помешать — это дисгемоглобины («хулиганы без билетов»). Слишком высокая концентрация дисгемоглобинов (COHb и MetHb) приводит к падению активной и эффективной концентрации гемоглобина и, соответственно, к гипоксии.
При отравлении угарным газом образуется карбоксигемоглобин (COHb), а при отравлении гипербарическим кислородом — метгемоглобин (MetHb). Карбоксигемоглобин и метгемоглобин не способны присоединять и транспортировать кислород.
· Отравление угарным газом (СО, окись углерода). Если при недостатке кислорода сжечь углеродсодержащее вещество, например, уголь или бензин, образуется угарный газ. Попадая в кровь с дыханием, молекула гемоглобина присоединяет к себе угарный газ вместо кислорода, и становится бесполезной для дыхания клеток. Способность присоединяться к гемоглобину у угарного газа в 300 раз выше, чем у кислорода, а его отделение от гемоглобина происходит в 10 000 раз медленнее, чем у кислорода [ 6 ].
Если угарный газ вывел из строя небольшое количество гемоглобина, последствия не будут серьезными. Но угарный газ имеет отвратительное свойство, которое делает его особенно опасным — цепляясь к атому железа, СО создает трудноразъединимое соединение — карбоксигемоглобин (Нb + СO = НbСO). В отличие от молекулы кислорода, он не может легко освободиться от гемоглобина, когда кровь завершает свой круг в организме и возвращается в легкие. Происходит процесс накопления.
И хотя содержание угарного газа в воздухе мало, со временем большая часть гемоглобина в крови начинает циркулировать впустую. Если в воздухе содержится 0,1 % CO, то около 80 % Hb крови превращается в НbСO. Карбоксигемоглобин не может связывать кислород, и в итоге постепенно развивается удушье.
Угарный газ попадает к нам в организм с выхлопным дымом автомобилей, выбросом промышленных предприятий, с сигаретным дымом и др.
В норме содержание НbСO в крови составляет 1 %. У курильщиков НbСO значительно выше — после выкуренной сигареты его содержание может возрасти до 5 % и более, а к вечеру доля НbСO может возрасти до 20 % общего гемоглобина в крови. [ 7 ] При содержании в крови 20 – 25 % НbСO человеку требуется специфическая врачебная помощь: дать чистый кислород, желательно под повышенным давлением.
· Сильные окислители. При действии сильных окислителей О2 может образовывать прочную химическую связь с железом гема, при которой атом железа становится трехвалентным. Такое соединение гемоглобина с кислородом называют метгемоглобином. Метгемоглобин не высвобождает кислород в тканевых капиллярах.
Метгемоглобинемия может быть врожденной, или развиться в результате некоторых видов острых химических отравлений (анилиновые красители, парацетамол, перманганат калия и пр.). Даже в обычных условиях у здоровых людей до 3 % гемоглобина крови может быть в виде метгемоглобина из-за постоянного поступления в кровь окислителей — перекиси, нитропроизводных органических веществ и др.
· Другие вещества. Гемоглобин легко взаимодействует и со многими другими растворенными в крови веществами. В частности, при взаимодействии с лекарственными препаратами, содержащими серу (например, принятие серных ванн), может образовываться сульфгемоглобин, сдвигающий кривую диссоциации НbO2 вправо.
Сатурация
Когда кислород (O2) соединяется с гемоглобином (Hb), он становится оксигемоглобином (HbO2). Кровь при этом приобретает ярко-алый цвет, что типично для артериальной крови. Венозная кровь содержит меньше кислорода, поэтому её цвет более темный.
У гемоглобина, как у транспортного белка, две задачи: присоединять кислород в легких и отдавать его тканям. Эти задачи противоположны по своей сути, но выполняются одним и тем же веществом. Поэтому стремление гемоглобина связываться с кислородом должно быть достаточным, чтобы обеспечить кровь кислородом, но не избыточным, чтобы не нарушить процесс отдачи кислорода клеткам.
Для обозначения меры насыщения кислорода гемоглобином, был придуман термин — сатурация (SO2). Динамическая взаимосвязь SO2, и давления кислорода в крови (pO2), дает кривую диссоциации HbO2 (рис. 1).
Середину этой кривой отметили точкой, при которой 50 % молекул гемоглобина связаны кислородом — это называют парциальным напряжением полунасыщения и обозначают как P50 (рН 7,4 температура 37 °С).
Увеличение P50 говорит о снижении сродства гемоглобина к кислороду, а его снижение — о возрастании.
Рис. 1-1; 1-2. Кривая диссоциации оксигемоглобина и ее характеристики:
А — кривая диссоциации оксигемоглобина и содержание кислорода в крови;
Б — смещение кривой диссоциации оксигемоглобина (сдвиг P50) облегчает захват O2 в легких и способствует диссоциации Hb – O2 на уровне тканей.
На «артериальной» части кривой существенное изменение PaO2 сопровождается незначительным сдвигом SO2. На «венозном» сегменте, напротив, небольшие изменения PO2 сопряжены с выраженным отклонением SO2
Напряжение кислорода (рО2)
Парциальное давление, или напряжение — выступает в качестве движущей силы перемещающей оксигемоглобин (HbO2) в организме. На протяжении всего пути кислорода, он будет перемещаться из зоны более высокого давления, в более низкую.
В атмосфере парциальное давление кислорода 150 – 160 мм рт. ст., а в конечной точке его путешествия — контуре респиратора митохондрии — pО2 всего 1 – 3 мм рт. ст. Таким образом, при прохождении кислорода к клеткам напряжение кислорода последовательно снижается, поскольку каждый этап транспорта связан с существенными издержками. Это явление получило название «кислородного каскада» (рис. 2).
Рис. 2. «Кислородный каскад». Описывает падение парциального давления кислорода, начиная от атмосферного воздуха и заканчивая мембраной митохондрий, конечного получателя кислорода.
Давайте посмотрим как это работает. Вдохнув воздух, парциальное давление кислорода в котором составляет 158 мм рт. ст., он попадает в верхние дыхательные пути, где нагревается и увлажняется. При прохождении области водяных паров (до 100 % относительной влажности), давление падает до 148 мм рт. ст. [ 8 ]
В альвеолах кислород смешивается с покидающим организм углекислым газом, что в обычных условиях уменьшает давление PO2 в альвеолярном воздухе до 103 – 107 мм рт. ст. Его могут уменьшить загрязнения вдыхаемого воздуха различными газами или нарушения легочной вентиляции [ 9 ], мы об этом говорили выше.
Потеря давления кислорода на альвеолярно-капиллярной мембране невелика — всего 1 мм рт. ст. Внутрилегочное шунтирование в артериальную кровь снижают PO2 до 90 – 100 мм рт. ст. В капиллярах тканей напряжение О2 падает до 40 мм рт. ст. Здесь кислород поступает в клетки органов и тканей — на поверхностях клеток парциальное давление составляет около 20 мм рт. ст., а в клеточных митохондриях — около 1 %. Когда PO2 в клетке становится равным 0,1 мм рт. ст. клетка погибает. [ 10 ]
Как мы видим, потеря кислорода может происходить на каждой из ступеней каскада.
Кроме парциального давления кислорода, на связывание гемоглобином кислорода влияют ряд вспомогательных факторов: напряжение углекислого газа (раCО2); температура легких (t °C); увеличение рН крови (эффект Вериго-Бора); и содержание в эритроците 2,3-ДФГ. Рассмотрим их.
Напряжение углекислого газа (раCО2)
Кроме транспорта кислорода к тканям, гемоглобин осуществляет обратный транспорт из клеток их конечного газового метаболита — углекислого газа (СО2). Содержание СО2 в венозной крови составляет 15 – 20 % [ 11 ].
Венозная кровь отдает альвеолам СО2, в результате чего в крови легочных капилляров снижается парциальное давление углекислого газа (рСО2). Это повышает сродство гемоглобина к кислороду, что приводит к насыщению артериальной крови кислородом.
В нормальных условиях у человека, при t 37 °С, рН 7,40 и pСO2 = 40 мм рт.ст. – p50 = 27 мм рт.ст.
Температура в лёгких
Реакция насыщения кислородом (оксигенации) гемоглобина, как и большинства химических реакций в организме, зависит от температуры. Мы это видели на примере работы ферментов. Оптимальная температура тела, является ключевым условием для поддержания Здоровья.
При понижении температуры легких присоединение О2 к гемоглобину ускоряется. Мы видим что с падением температуры кривая диссоциации НbО2 сдвигается влево (см. рис. 3). В этом случае гемоглобин активнее захватывает кислород, но в меньшей мере отдает его тканям.
Рис. 3. Кривые диссоциации оксигемоглобина:
а) — при одинаковой температуре (Т = 37 °С) и различном парциальном давлении углекислого газа (pCO2);
б) — при одинаковом pCO2 (40 мм рт. ст.) и различной температуре.
По вертикали отмечен процент молекул гемоглобина связанных с кислородом (НbO2), а по горизонтали — уровень напряжения кислорода (рO2).
Содержание в эритроците 2,3-ДФГ
2,3 Дифосфоглицерат (ДФГ) является промежуточным продуктом бескислородного производства АТФ (см. гликолиз). 2,3-ДФГ служит некоторой защитой от гипоксии в случае снижения поступления кислорода при ситуациях подъема в горы на высоту свыше 3-х км над уровнем моря, при хронических заболеваниях легких, сердечной недостаточности с цианозом, недостатка гемоглобина и других патологических причин, которые снижают поступление кислорода клеткам.
Например, при дыхательной недостаточности наблюдается резкий подъем уровня 2,3-ДФГ, который сохраняется на протяжении всего срока заболевания. Есть взаимосвязь между степенью тяжести дыхательной недостаточности, выраженностью дыхательной гипоксемии и уровнем 2,3-ДФГ.
В случаях нехватки кислорода в тканях, синтез 2,3-ДФГ в эритроцитах увеличивается, и отделение О2 от НbO2 ускоряется, что частично компенсирует кислородный голод тканей. У пожилых людей содержание 2,3-ДФГ в эритроцитах повышено, что указывает на отчаянную попытку организма препятствовать развитию гипоксии тканей.
Процесс старения сопровождается появлением новых качеств, направленных на сохранение компенсаторных механизмов, однако они лишь в неполной мере поддерживают процессы адаптации [ 12 ].
У тренирующих выносливость спортсменов, концентрация 2,3-ДФГ в эритроцитах на 15 – 20 % выше, чем не у спортсменов [ 13 ]. В норме содержание 2,3-ДФГ в сыворотке крови составляет 1,6 – 2,6 ммоль/л.
В крови мужчин уровень эритроцитов в норме 4 – 5,1 х1012/л, в крови женщин — 3,7 – 4,7х1012/л.
В норме уровень гемоглобина у мужчин 130 – 160 г/л, у женщин — 115 – 145 г/л. Обычно его определяют с помощью гемометра Сали, но этот метод дает до 30 % ошибку, поэтому лучше использовать гемоглобинцианидный или другие методы. [ 14 ]
Содержание оксигенированного гемоглобина (НbО2) в артериальной крови выше 94 % считается нормой. При содержании 90 % ткани испытывают кислородное голодание и необходимо принимать срочные меры, улучшающие доставку в них кислорода.
Если мы не живем высоко в горах, у нас нет хронических болезней легких, и наши альвеолы не забиты пылью и табачной смолой, при этом у нас сбалансировано питание, хороший гемоглобин, мы не работаем в холоде и дышим воздухом без превышения ПДК — нам не стоит особенно волноваться о проблеме насыщения гемоглобина кислорода пришедшего из лёгких.
Большинство людей всегда имеет высокое насыщение крови кислородом — содержание НbО2 в возвращающейся из капиллярной сети в легкие венозной крови составляет 67 – 75 % [ 15 ]. Как увеличить отдачу тканям уже имеющегося кислорода в крови — вот задача достойная самого пристального нашего внимания. Как это делают термальные бикарбонатные ванны, мы узнаем чуть дальше.
Сейчас мы остановились на том, что НbО2 должен «доехать» до места назначения — например, к мизинцу левой ноги. Успех его доставки будет зависеть от состояния кровеносных сосудов и густоты крови. Давайте это рассмотрим прямо сейчас.
источник