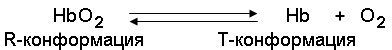Гемоглобин и миоглобин.
Гемоглобин – состоит из белка глобина и небелковой части гема, в составе которого имеется атом Fе(II). Молекула Нb содержит 4 гема и является белком с четвертичной структурой (4 субъединицы – 2 α-цепи и 2 β-цепи, каждая из которых имеет свою третичную структуру и особым образом уложена вокруг кольца гема). Каждая из субъединиц похожа на молекулу миоглобина. Молекула гемоглобина способна присоединять 4 молекулы О2. Гемоглобин переносит кислород от легких к тканям, а углекислый газ в обратном направлении. Нb + О2 → НbО2 – оксигемоглобин – в капиллярах легких Нb насыщается кислородом при высоком парциальном давлении (100 мм рт. ст.).
В капиллярах тканей, где парциальное давление кислорода низкое (5 мм рт. ст.) НbО2 → на Нb и О2. Кислород переходит в ткани, а освободившийся Нb соединяется с поступившим из тканей СО2 и превращается в НbСО2 – карбгемоглобин, который переносится с кровью к легким. В легочных капиллярах НbСО2 → Нb + СО2. СО2 выводится из организма при выдыхании, а Нb вновь насыщается кислородом.
Сравнение зависимости насыщения от парциального давления кислорода показывает, что при парциальных давлениях кислорода, характерных для тканей, гемоглобин отдает значительные количества кислорода. В гемоглобине происходит перемещение атома железа в плоскость гема с одновременным изменением конформации полипептидной цепи, но так как молекула Нb имеет четвертичную структуру и отдельные цепи связаны между собой, то это позволяет передать изменения конформации на область связи между полипептидными цепями. Это изменяет положение в пространстве всей молекулы и облегчает доступ О2 к остальным гемам молекулы Нb. Одновременно это изменение конформации сопровождается появлением на поверхности групп, которые, диссоциируя, отдают протоны (Н + ) в окружающую среду. При понижении парциального давления кислорода события повторяются в обратном направлении: отдача кислорода идет по мере снижения парциального давления, гемоглобин переходит в другое конформационное состояние, при этом из окружающей среды (ткань), где высока концентрация протонов, протоны присоединяются к гемоглобину. Такие изменения конформации позволяют гемоглобину не только регулировать обеспечение кислородом тканей, но и участвовать в поддержании кислотно-основного равновесия в организме.
При отравлении угарным газом в крови образовывается карбоксигемоглобин Нb + СО → НbСО – прочное соединение, препятствует образованию НbО2 и транспорту кислорода. Возникает кислородное голодание.
Различные формы Нb определяются методом спектрального анализа. У взрослого человека молекула НbА (2 α-цепи и 2 β-цепи). Но от целого ряда условий состав цепей гемоглобина может меняться. У плода НbF (фетальный – 2 α-цепи, 2 γ-цепи) – он лучше связывает кислород при его относительной недостаточности в период внутриутробного развития.
В результате определенных нарушений генетического аппарата клетки Нb патологический, а заболевания – гемоглобинопатии наследственного происхождения.
Классическим примером является серповидно-клеточная анемия(аномальный гемоглобин – причина). Синтезируется β-цепь необычного состава, в которой валин занимает место глутаминовой кислоты, присутствующей в нормальном НbА. Изменение такое вызывает нарушение структуры и свойств Нb, который обозначается НbS – он легко выпадает в осадок, обладает сниженной способностью переносить кислород. В результате эритроциты, содержащие НbS приобретают форму серпа. Клинически: нарушается кровообращение и дыхание, иногда летальный исход.
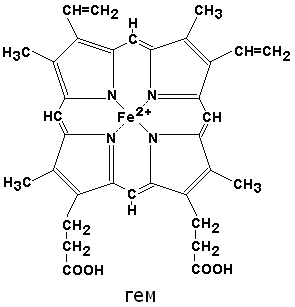
Миоглобин – хромопротеид, содержащийся в мышцах. Он обладает простетической группой – гемом, циклическим тетрапирролом, придающим ему красный цвет. Тетрапиррол состоит из 4 пиррольных колец, соединенных в плоскую молекулу метиленовыми мостиками. Атом железа занимает центральное положение в этой плоской молекуле. Железо в составе гема цитохромов способно менять свою валентность, в гемоглобине и миоглобине изменение валентности железа нарушает их функцию. Главная функция и гемоглобина и миоглобина – связывание кислорода.
Миоглобин – сферическая молекула, состоит из 153 аминокислот с общей молекулярной массой 17000. он состоит из одной цепи, аналогичной субъединице Нb. На уровне вторичной структуры он образует 8 α-спиральных участков, захватывающих почти 75% всех аминокислот молекулы. Атом железа в геме миоглобина, не связанный с кислородом, выступает из плоскости молекулы на 0,03 нм. В оксигенированной форме атом железа как бы погружается в плоскость молекулы гема. Образуя связь с одной из молекул гистидина глобиновой части, железо при соединении с кислородом изменяет и конформацию белка. Миоглобин удобен для хранения кислорода, но не удобен для транспорта его по крови. Это объясняется процессом насыщения миоглобина в зависимости от парциального давления кислорода. Так как в легких парциальное давление кислорода 13,3 кПа, миоглобин хорошо бы насыщался кислородом, но в венозной крови это давление составляет 5,3 кПа, а в мышцах ещё меньше – 2,6 кПа. Миоглобин в таких условиях сможет отдавать мало кислорода и будет недостаточно эффективен в транспорте кислорода от легких к тканям.
Гем –простетическая группа многих важных с точки зрения функций белков.
Гем – небелковая часть, в составе находится Fе (ΙΙ), гем входит в состав флавопротеинов, гемопротеидов, гемоглобина, миоглобина, каталазы, пероксидазы, цитохромов.
Знание вопросов биосинтеза и распада гема призвано помочь в понимании роли гемопротеинов в организме. Нарушение этих процессов связано с развитием заболеваний. Так, с нарушением биосинтеза гема связана группа заболеваний – порфирии.
Порфирии – группа заболеваний с нарушением биосинтеза гемма. группа заболеваний с нарушением биосинтеза гемма. Наблюдается накопление побочных промежуточных продуктов, которые откладываются в различных органах или выделяются в повышенных количествах с калом или мочой. Появление в моче в значительных количествах веществ незавершенного синтеза гемма либо продуктов его распада (копропорфирин и уропорфирин) вызывает порфиринурию. Моча пурпурно-красного цвета. Это бывает при некоторых поражениях печени, кишечных кровотечениях, интоксикациях. Порфиринурия является одним из признаков отравления свинцом, когда нарушается транспорт Fe, необходимого для синтеза гемоглобина.
Гораздо чаще встречаются патологические состояния, связанные с распадом гема и нарушением выведения из организма продуктов его катаболического превращения. Наиболее распространенной является желтуха.
Схема синтеза гема  глицин + сукцинил – КоА синтаза 5-аминолевулиновой кислоты глицин + сукцинил – КоА синтаза 5-аминолевулиновой кислоты   5 – аминолевулиновая кислота Уропорфириноген ΙΙΙ В цитоплазме клеток 5 – аминолевулиновая кислота Уропорфириноген ΙΙΙ В цитоплазме клеток  Копропорфириноген ΙΙΙ Копропорфириноген ΙΙΙ
Из многих представителей хромопротеидов для человека наибольшее значение имеет гемоглобин. Хромопротеиды растительного и животного происхождения, находящиеся в пищевых продуктах, подвергаются действию ферментов пищеварительного тракта. Гемоглобин пищи, находящийся в ней в денатурированном состоянии, легко гидролизуется, распадаясь на простетическую группу и белок. Белок расщепляется пепсином и трипсином с образованием пептидов и аминокислот. Следовательно, глобиновая часть гемоглобина подвергается обычным превращениям в ЖКТ, которые свойственны простым белкам. Простетическая группа – гемм – окисляется в гематин. Гематин всасывается в кишечнике очень плохо. Эти пигменты выделяются с калом частью в неизмененном виде, частью в виде различных продуктов, образующихся под влиянием бактерий кишечника. Обычные химические способы обнаружения крови в кале, имеющие большое значение для клиники, основаны на реакциях гематина, и могут дать достоверные результаты только в том случае, если диета не содержит мяса, в котором присутствует миоглобин. Время жизни эритроцитов у взрослого организма составляет около 4 месяцев. Спустя этот период времени эритроциты разрушаются в основном в печени, селезенке и костном мозге. В ходе разрушения из эритроцитов высвобождается гемоглобин (8 – 9 г в сутки). Дата добавления: 2018-03-01 ; просмотров: 4630 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ источник Биохимия лекции / 1 семестр / Задания / Миоглобин гемоглобинМиоглобин и гемоглобин: сходство и различия структуры и функции. 3.2.1. Среди хромопротеинов различают гемопротеины (содержат в качестве простетической группы порфириновые производные) и флавопротеины (содержат производные рибофлавина — витамина B2). Хромопротеины участвуют в осуществлении многих жизненно важных функций, таких как тканевое дыхание, перенос кислорода, окислительно-восстановительные реакции, светоощущение, фотосинтез в растительных клетках и другие процессы. 3.2.2. К гемопротеинам относятся: гемоглобин, миоглобин, цитохромы, пероксидаза, каталаза. Эти белки содержат в качестве простетической группой гем. По своему химическому строению гем представляет собой протопорфирин IX, связанный с двухвалентным железом. Протопорфирин IX — органическое соединение, относящееся к классу порфиринов. Протопорфирин IX содержит четыре замещённых пиррольных кольца, соединённых метиновыми мостиками =СН—. Заместителями в пиррольных кольцах являются: четыре метильные группы СН3—, две винильные группы СН2=СН— и два остатка пропионовой кислоты — СН2—СН2—СООН. Гем соединяется с белковой частью следующим образом. Неполярные группы . протопорфирина IX взаимодействуют с гидрофобными участками аминокислот при помощи гидрофобных связей. Кроме того, имеется координационная связь между атомом железа и имидазольным радикалом гистидина в белковой цепи. Ещё одна координационная связь атома железа может использоваться для связывания кислорода и других лигандов. Присутствие в биологическом материале гемсодержащих белков обнаруживается при помощи бензидиновой пробы (при добавлении бензидина и пероксида водорода исследуемый раствор окрашивается в сине-зелёный цвет). 3.2.3. Сравните структуру и функцию миоглобина и гемоглобина, запомните характерные особенности каждого из этих белков. Миоглобин — хромопротеин, присутствующий в мышечной ткани и обладающий большим сродством к кислороду. Молекулярная масса этого белка около 16000 Да, Молекула миоглобина имеет третичную структуру и представляет собой одну полипептидную цепь, соединённую с гемом. Миоглобин не обладает аллостерическими свойствами (см. 2.4.), кривая насыщения его кислородом имеет вид гиперболы (рисунок 4). Функция миоглобина заключается в создании в мышцах кислородного резерва, который расходуется по мере необходимости, восполняя временную нехватку кислорода. Гемоглобин (Hb) — хромопротеин, присутствующий в эритроцитах и участвующий в транспорте кислорода к тканям. Гемоглобин взрослых людей называется гемоглобином А (Hb A). Молекулярная масса его составляет около 65000 Да. Молекула Hb А имеет четвертичную структуру и включает четыре субъединицы — полипептидные цепи (обозначаемые α1, α2, β1 и β2, каждая из которых связана с гемом. Запомните, что гемоглобин относится к аллостерическим белкам, его молекулы могут обратимо переходить из одной конформации в другую. При этом изменяется сродство белка к лигандам. Конформация, обладающая наименьшим сродством к лиганду, называется напряжённой, или Т-конформацией. Конформация, обладающая наибольшим сродством к лиганду, называется релаксированной, или R-конформацией. R- и Т-конформации молекулы гемоглобина находятся в состоянии динамического равновесия: Различные факторы среды могут сдвигать это равновесие в ту или иную сторону. Аллостерическими регуляторами, влияющими на сродство Hb к O2, являются: 1) кислород; 2) концентрация Н + (рН среды); 3) углекислота (СO2) ; 4) 2,3-дифосфоглицерат (ДФГ) . Присоединение молекулы кислорода к одной из субъединиц гемоглобина способствует переходу напряжённой конформации в релаксированную и повышает сродство к кислороду других субъединиц той же молекулы гемоглобина. Это явление получило название кооперативного эффекта. Сложный характер связывания гемоглобина с кислородом отражает кривая насыщения гемоглобина O2, имеющая S-образную форму (рисунок 3.1). Повышение содержания СO2, Н + , ДФГ на фоне низкого парциального давления O2 в тканях способствует взаимодействию этих факторов с гемоглобином и переходу R-конформации в Т-конформацию. Это приводит к смещению равновесия в уравнении (1) вправо. Выделившийся O2 поступает в ткани. Рисунок 4. Кривые насыщения миоглобина (1) и гемоглобина (2) кислородом. источник Разница между гемоглобином и миоглобиномОсновное отличие — гемоглобин против миоглобинаГемоглобин и миоглобин являются двумя типами глобиновых белков, которые служат в качестве связывающих кислород белков. Оба белка способны увеличивать количество растворенного кислорода в биологических жидкостях позвоночных, а также у некоторых беспозвоночных. Органические простетические группы со сходными характеристиками участвуют в связывании кислорода в обоих белках. Но трехмерная ориентация в пространстве или стереоизомерия гемоглобина и миоглобина различны. Из-за этой разницы количество кислорода, которое может связываться с каждой из молекул белка, также различно. Гемоглобин способен плотно связываться с кислородом в то время как миоглобин неспособен к прочному связыванию с кислородом. Это различие между гемоглобином и миоглобином приводит к их различным функциям; гемоглобин находится в кровотоке, транспортируя кислород от легких к остальной части тела в то время как миоглобин находится в мышцах, выделяя необходимый кислород. Ключевые области покрыты1. Что такое гемоглобин Ключевые термины: гемоглобин, миоглобин, кислород, гем, белки, глобиновый белок, кровь Что такое гемоглобинГемоглобин — это многочастичный глобулярный белок с четвертичной структурой. Он состоит из двух α и двух β субъединиц, расположенных в тетраэдрической структуре. Гемоглобин является железосодержащим металлопротеином. Каждая из четырех глобулярных белковых субъединиц связана с небелковой протезной гемовой группой, которая связывается с одной молекулой кислорода. Производство гемоглобина происходит в костном мозге. Глобиновые белки синтезируются рибозомами в цитозоле. Гемовая часть синтезируется в митохондриях. Заряженный атом железа удерживается в порфириновом кольце путем ковалентного связывания железа с четырьмя атомами азота в одной плоскости. Эти атомы N принадлежат имидазольному кольцу остатка гистидина F8 каждой из четырех субъединиц глобина. В гемоглобине железо существует как Fe 2+ , придавая красный цвет эритроцитам. У людей есть три типа гемоглобина: гемоглобин А, гемоглобин А2 и гемоглобин Ф. Гемоглобин А это распространенный тип гемоглобина, который кодируется HBA1, HBA2, а также ГБД Гены. Четыре субъединицы гемоглобина А состоят из двух α и двух субъединиц β (α2β2). Гемоглобин А2 и гемоглобин F редки и состоят из двух α и двух субъединиц δ и двух α и двух субъединиц γ соответственно. У младенцев тип гемоглобина Hb F (α2γ2). Поскольку молекула гемоглобина состоит из четырех субъединиц, она может связываться с четырьмя молекулами кислорода. Таким образом, гемоглобин обнаружен в эритроцитах, как переносчик кислорода в крови. Из-за присутствия в структуре четырех субъединиц связывание кислорода увеличивается, когда первая молекула кислорода связывается с первой гем-группой. Этот процесс определяется как кооперативное связывание кислорода. Гемоглобин составляет 96% сухого веса эритроцитов. Некоторая часть углекислого газа также связана с гемоглобином для транспортировки из тканей в легкие. 80% углекислого газа транспортируется через плазму. Структура гемоглобина показана на Рисунок 1. Рисунок 1: Структура гемоглобина Функция гемоглобинаЧто такое миоглобинМиоглобин является кислородсвязывающим белком в мышечных клетках позвоночных, придающим мышцам отчетливый красный или темно-серый цвет. Это исключительно выражено в скелетных мышцах и сердечных мышцах. Миоглобин составляет 5-10% цитоплазматических белков в мышечных клетках. Поскольку аминокислотные изменения в полинуклеотидных цепях гемоглобина и миоглобина являются консервативными, как гемоглобин, так и миоглобин имеют сходную структуру. Кроме того, миоглобин представляет собой мономер, состоящий из одной полинуклеотидной цепи, состоящей из одной гем-группы. Следовательно, он способен связываться с одной молекулой кислорода. Таким образом, в миоглобине не происходит кооперативного связывания кислорода. Но аффинность связывания миоглобина является высокой по сравнению с таковой гемоглобина. В результате миоглобин служит белком, запасающим кислород в мышцах. Миоглобин выделяет кислород, когда мышцы функционируют. 3-D структура гемоглобина показана на фигура 2. Рисунок 2: Миоглобин Сходства между гемоглобином и миоглобином
Разница между гемоглобином и миоглобиномОпределениеГемоглобин: Гемоглобин — это красный белок, который отвечает за транспортировку кислорода в крови позвоночных. Миоглобин: Миоглобин — это красный белок с гемом, который переносит и запасает кислород в мышечных клетках. Молекулярный весГемоглобин: Молекулярная масса гемоглобина составляет 64 кДа. Миоглобин: Молекулярная масса гемоглобина составляет 16,7 кДа. СоставГемоглобин: Гемоглобин состоит из четырех полипептидных цепей. Миоглобин: Миоглобин состоит из одной полипептидной цепи. Четвертичная структураГемоглобин: Гемоглобин представляет собой тетрамер, состоящий из двух α и двух β субъединиц. Миоглобин: Миоглобин является мономером. Следовательно, ему не хватает четвертичной структуры. Количество молекул кислородаГемоглобин: Гемоглобин связывается с четырьмя молекулами кислорода. Миоглобин: Миоглобин связывается только с одной молекулой кислорода. Кооперативное связываниеГемоглобин: Поскольку гемоглобин является тетрамером, он проявляет кооперативное связывание с кислородом. Миоглобин: Поскольку миоглобин является мономером, он не проявляет кооперативного связывания. Сродство к кислородуГемоглобин: Гемоглобин обладает низким сродством к связыванию с кислородом. Миоглобин: Миоглобин обладает высоким сродством связываться с кислородом, что не зависит от концентрации кислорода. Связь с кислородомГемоглобин: Гемоглобин способен плотно связываться с кислородом. Миоглобин: Миоглобин не способен тесно связываться с кислородом. ВхождениеГемоглобин: Гемоглобин находится в кровотоке. Миоглобин: Миоглобин находится внутри мышц. Гемоглобин: Гемоглобин А, гемоглобин А2 и гемоглобин F являются типами гемоглобина у людей. Миоглобин: Единственный тип миоглобина обнаружен во всех клетках. функцияГемоглобин: Гемоглобин берет кислород из легких и транспортирует к остальной части тела. Миоглобин: Миоглобин накапливает кислород в мышечных клетках и выделяет при необходимости. ЗаключениеГемоглобин и миоглобин являются двумя связывающими кислород глобулярными белками у позвоночных. Гемоглобин представляет собой тетрамер, который совместно связывается с четырьмя молекулами кислорода. Миоглобин — это мономер, состоящий из одной группы гемов. Поскольку связывающая способность гемоглобина выше, чем у миоглобина, гемоглобин используется в качестве транспортирующего кислород белка в крови. Миоглобин используется в качестве запасающего кислород белка в мышечных клетках. Сродство связывания кислорода с миоглобином выше, чем у гемоглобина. Основное различие гемоглобина и миоглобина заключается в их функции. Функциональное различие гемоглобина и миоглобина возникает из-за разницы их трехмерной структуры. Ссылка:1. «Миоглобин». Гемоглобин и миоглобин. Н.п., н.д. Web. источник |