Оптическая изомерия молочной и винной кислот
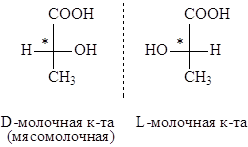
Для идентификации оптических изомеров гидроксилслдержащих веществ применяют D-L-номенклатуру. Оптические изомеры винной кислоты представлены на рисунке.
Композиция, состоящая из равных количеств энантиомеров, называется рацематом.
Антиподы (энантиомеры), диастереомеры, мезоформы, рацематы. Методы разделения рацематов.
Альдегидо- и кетокислоты. Пировиноградная кислота, ее получение. Химические свойства функциональных групп пировиноградной кислоты, превращение ее в аланин. Ацетоуксусный эфир, получение сложно-эфирной конденсацией. Понятие таутомерии. Двойственная реакционная способность ацетоуксусного эфира и его натриевого производного.
Альдегидо- и кетокислоты( или Оксокислоты )содержат дополнительно альдегидную или кетонную группу.
| Формула кислоты | Название кислоты |
 | глиоксиловая или глиоксалевая кислота, содержится в недозрелых фруктах |
 | пировиноградная кислота (соли – пируваты), является конечным продуктом метаболизма глюкозы в процессе гликолиза. |
 | ацетоуксусная кислота (соли – ацетилацетаты) |
Альдегидо- и кетокислоты встречаются в природных продуктах, некоторые из них играют важную роль в обмене веществ, являются промежуточными продуктами при спиртовом брожении сахаров.
Дата публикования: 2014-11-18 ; Прочитано: 4557 | Нарушение авторского права страницы
studopedia.org — Студопедия.Орг — 2014-2020 год. Студопедия не является автором материалов, которые размещены. Но предоставляет возможность бесплатного использования (0.001 с) .
источник
Явление оптической изомерии на примере молочной кислоты
Изучение гидроксикислот имело исключительно большое значение для развития науки о пространственном строении молекул – стереохимии. Особенностью пространственного строения многих гидроксикислот является наличие атома углерода, имеющего четыре различных заместителя. Например, молочная кислота:
Такие атомы называются ассимметрическими углеродными атомами или хиральными (хиральными центрами). В формулах асимметрические углеродные атомы обозначаются звездочкой.
Молекулы, имеющие асимметрические углеродные атомы, могут быть представлены в виде двух пространственных изомеров, различающихся как предмет и его зеркальное отображение:
Изомеры, отличающиеся друг от друга только расположением атомов в пространстве, называются стереоизомерами. Расположение атомов, характеризующее определенный стереоизомер, называется конфигурацией. Стереоизомеры, различающиеся как предмет и его зеркальное отражение называются энантиомерами. Энантиомеры являются оптически активными веществами – они способны вращать плоскость поляризации света. Причем из пары энантиомеров один вращает плоскость поляризации вправо. Такой изомер называется правовращающим и обозначается знаком «(+)». Другой изомер вращает плоскость поляризации влево. Такой изомер называется левовращательным и обозначается знаком «(-)». Изомеры, отличающиеся только знаком вращения называются оптическими антиподами.
При изображении оптически активных соединений пользуются проекционными формулами, представляющих собой проекции тетраэдрических моделей соответствующих молекул на плоскость чертежа:
При изображении проекционных формул принимается, что группы, расположенные сверху и снизу, находятся за плоскостью чертежа, а группы, расположенные слева и справа — перед плоскостью чертежа. Поэтому формулы нельзя поворачивать в плоскости чертежа на 90 0 и можно поворачивать на 180 0 . Например:
Соединения 1 и 2 являются оптическими антиподами, поскольку 2 получено путем поворота 1 на 90 0 . Формула 3 получена из 1 поворотом на 180 0 , поэтому 3 эквивалентно 1.
Для направления и величины вращения плоскости поляризации не существует определенных закономерностей взаимосвязи со строением оптически активных соединений. Можно отмечать как факт, что молочная кислота, содержащаяся в мышцах, вращает плоскость поляризации вправо и известна как правовращающая (+). Также как факт принимается то, что молочная кислота, образующаяся при брожении сахарозы, в присутствии бактерий, вращает плоскость поляризации влево и называется левовращающей (-).
Какими–либо химическими методами невозможно установить, как в молекулах оптических изомеров атомы расположены относительно друг друга. Т.е. химически невозможно установить какова природная или абсолютная конфигурация оптически активного вещества. Впервые ученые смогли это установить только в 1949 году физическим методом рентгеноструктурного анализа.
До этого момента химики могли ограничиться только установлением конфигурации оптически активных веществ относительного какого-либо оптически активного вещества, принятого за стандарт. Так называемая относительная конфигурация. Основой для такого подхода было то, что можно провести превращение вещества, принятого за стандарт, в интересующее вещество таким образом, чтобы конфигурация асимметрического атома углерода не нарушалась.
В 1906 году в качестве стандарта был избран глицериновый альдегид, поскольку он является простейшим полигидроксикарбонильным соединением, способным к оптической изомерии. Правовращающему глицериновому альдегиду была приписана следующая конфигурация, обозначенная как «D»:
Соответственно его оптическому антиподу была приписана следующая конфигурация и обозначена как «L»:
В 1951 году методами рентгеноструктурного анализа было показано, что выбранная наугад абсолютная конфигурация глицеринового альдегида оказалась правильной.
По абсолютной конфигурации глицеринового альдегида были установлены относительные конфигурации других оптически активных веществ. Так относительная конфигурация молочной кислоты была установлена по D-(+)-глицериновому альдегиду следующим образом:
Окислением альдегидной группы в карбоксильную и восстановлением гидроксиметиленовой группы в метильную было установлено, что D-конфигурации соответствует левовращающая молочная кислота.
Подобным образом были установлены относительные конфигурации многих веществ.
Так для оптически активной яблочной кислоты, вращающей плоскость поляризации вправо, установлена следующая конфигурация относительно D-(+)-глицеринового альдегида:
При обработке D-(+)-яблочной кислоты пятихлористым фосфором получается L-(-) хлорянтарная кислота:
Т.е. при этом произошло обращение конфигурации.
Если на L-(-) хлорянтарную кислоту подействовать влажной окисью серебра то получается L-(-)-яблочная кислота:
Однако если яблочную кислоту получить присоединением воды к фумаровой или малеиновой кислоте то получается продукт, не обладающий оптической активностью:
Так как строение яблочной кислоты обуславливает обязательную оптическую активность, то в случае гидратации непредельных кислот получается смесь равных количеств двух оптических изомеров.
Совокупность равных количеств энантиомеров называется рацемической модификацией или рацематом.
Рассмотренные три случая различаются по механизмам образования продуктов. Рацемическая модификация образуется в том случае если реакция протекает через стадию устойчивого карбкатиона, атака которого возможна с двух сторон.
Если атака карбкатиона возможна только с одной стороны, то продукт сохраняет конфигурацию. Такой случай возможен в дикарбоновых кислотах, где за счет взаимодействия карбоксильных групп доступ к реакционному центру возможен только с одной стороны.
При нуклеофильном замещении, протекающим по механизму SN2, происходит обращение конфигурации. Так называемое Вальденовское обращение.
Усложнение строения оптически активных веществ стало требовать систематизации обозначений конфигурации. Была введена так называемая R, S система. Согласно этой системе, сначала определяют старшинство, или последовательность заместителей, связанных асимметрическим атомом, исходя из правил старшинства.
1. Если с асимметрическим атомом углерода связаны четыре различных атома, то старшинство определяется порядковым номером в таблице Менделеева, чем больше номер, тем старше заместитель.
2. Если старшинство нельзя определить по первым атомам, связанным с асимметрическим атомом, то старшинство аналогично определяют по вторым атомам и т.д.
3. Если атомы, связанные с асимметрическим атомом углерода, имеют разное количество заместителей, построенных из атомов с одинаковым порядковым номером, то старшим — является атом, имеющий большее число заместителей.
4. Если атом соединен двумя или тремя связями, то его считают за два атома. Из этого следует, что СООН старше СНО и СНО старше СН2ОН.
После определения старшинства молекулу располагают таким образом, чтобы самая младшая группа была направлена от наблюдателя, и рассматривают расположение оставшихся групп. Если старшинство убывает по часовой стрелке, то конфигурацию обозначают символом «R»- от латинского «правый». Если старшинство убывает против часовой стрелки, то конфигурацию обозначают символом «S» -от латинского «левый».
При этом R, S — система отражает абсолютную конфигурацию асимметрического атома углерода. Согласно этой системе энантиомеры глицеринового альдегида будут обозначены следующим образом:
Полное название оптически активного соединения отражает конфигурацию и направление вращения. Рацемическую модификацию можно обозначать символом (R, S), например (R,S)-яблочная кислота.
Каждому асимметрическому атому углерода соответствуют два антипода и один рацемат. Общая формула количества оптических изомеров N =2 n , где n – число асимметрических атомов углерода. Однако для дигидроксиянтарной кислоты, имеющей два хиральных центра:
Дигидроксиянтарные кислоты называются винными кислотами. Оптически активные изомеры винной кислоты можно изобразить следующими проекционными формулами:
Рацемическая смесь винных кислот (R,S)-винная — называется виноградной кислотой. (+)-Винная кислота называется еще виннокаменной содержится в соке ягод. Ее калийная соль выделяется в виде винного камня при брожении виноградного сока. (-)-Винную кислоту получают из виноградной кислоты.
Приведенные примеры говорят о двух изомерах и одном рацемате. По формуле должны быть еще два изомера. Этим изомерам должны соответствовать следующие проекционные формулы:
Если одну из проекционных формул мезовинной кислоты повернуть на 180 0 , то проекции совместятся. Т.е. формулы представляют один и тот же стереоизомер. Его особенностью является то, что вращение, вызываемое одним асимметрическим атомом углерода — компенсируется вращением в противоположную сторону, обусловленное другим атомом углерода.
В данном случае оптическая неактивность стереоизомера обусловлена симметрией молекулы.
При этом мезовинная кислота не является зеркальным отображением винных кислот. Стереоизмеры, не являющиеся зеркальным отображением, называются диастереомеры.
Ранее были описаны структурная изомерия, обусловленная различным порядком чередования атомов и связей в молекулах, и два вида пространственной изомерии: поворотной и геометрической (цис-транс), связанные с различным расположением фрагментов молекул одинаковой структуры в пространстве. Существует ещё один вид стереоизомерии – оптическая изомерия.
Оптические изомеры одинаковы по всем своим физическим и химическим свойствам и различаются лишь в двух отношениях.
1 При кристаллизации они образуют кристаллы, не имеющие плоскости симметрии и относящиеся друг к другу как предмет к своему зеркальному отображению. Это свойство позволило Пастеру открыть явление оптической изомерии. При кристаллизации винной кислоты он визуально обнаружил кристаллы двух различных типов и разделив их, выделил чистые стереоизомерные формы винной кислоты.
2 Оптические изомеры по разному относятся к поляризованному свету.
В луче света колебания электрического и магнитного векторов происходят во взаимно-перпендикулярных направлениях, а также перпендикулярно направлению распространению луча. Причём направление колебаний, например, электрического вектора хаотически меняется во времени, изменяя соответственно направление колебания вектора магнитного. В поляризованном луче колебания электрического и магнитного векторов совершаются для каждого в одной строго фиксированной плоскости, плоскости поляризации. При прохождении поляризованного луча через некоторые прозрачные жидкие и кристаллические вещества плоскость поляризации поворачивается. Соединения, вращающие плоскость поляризации поляризованного луча, называются оптически деятельными или оптически активными. Для количественного сравнения оптической деятельности различных веществ, вычисляют величину удельного вращения. Поскольку величина угла, вращения плоскости поляризации света помимо природы вещества зависит еще от температуры, длины волны света, толщины слоя вещества, через который проходит поляризованный свет, а для растворов ещё от растворителя и концентрации вещества, удельное вращение при постоянной температуре и длине волны света равно

где α – угол поворота плоскости поляризации при толщине слоя l и плотности вещества d, t – температура, D – фиксированная длина волны желтой линии из спектра натрия.

где С – концентрация раствора в граммах вещества, на 100 мл раствора.
Молочная кислота, получаемая при ферментации сахарозы с помощью бактерий, вращает плоскость поляризации света влево (против часовой стрелки). Она называется левовращающей или левой молочной кислотой и обозначается: (–) – молочная кислота.
Молочная кислота, вращающая плоскость поляризации света вправо, называется правой молочной кислотой и обозначается: (+) – молочная кислота. Эта оптическая форма молочной кислоты выделяется из мышц животных и называется мясомолочной кислотой.
В кристаллической фазе оптическая активность вещества связана с асимметрией строения кристалла. В жидкой и газовой фазах она связана с асимметрией молекул. В 1874 г. Вант-Гофф и Лебель – основоположники стереохимической теории – почти одновременно отметили, что оптически активные вещества содержат в своих молекулах хотя бы один углерод, связанный с четырьмя различными группами. Такие атомы углерода называются асимметрическими. Наличие в структуре молекулы асимметрического атома углерода является признаком асимметрии молекул соединения, а следовательно, и оптической активности вещества.
При рассмотрении оптической изомерии асимметрические атомы углерода обычно отмечают звездочкой (*):
Изомерия – это явление, обусловленное существованием молекул, имеющих одинаковый качественный и количественный состав, но различающихся по химическим и физическим свойствам вследствие неодинакового расположения атомов (или групп атомов) в молекуле или их ориентации в пространстве.
Известно, что свет представляет собой электромагнитные волны, фаза колебания которых, перпендикулярна направлению их распространения. В естественном свете такие колебания происходят во всех возможных плоскостях. Если же луч света пропустить через кристалл, имеющий строго упорядоченное строение (рис 1), то электромагнитные колебания будут совершаться только в одной определенной плоскости. Свет, фаза колебания которого вне этой плоскости, призмой задерживается. Такой луч света называется поляризованным (плоскополяризованным). Плоскость, перпендикулярная плоскости колебаний поляризованного света, является плоскостью поляризации. Обычно в качестве стереорегулярого кристалла используют так называемую призму Николи.
Рис. 1. Схематическое изображение электромагнитных колебаний в луче обыкновенного и поляризованного света; 1 — в обыкновенном свете; 2 — в поляризованном свете; 3 — плоскость поляризации; 4 — призма Николя
Оптически активные соединения «вращают» плоскость поляризации вправо или влево (рис.2). Для обозначения этих вращений используют знаки (+) и (-), которые ставят перед формулой оптического изомера.
Рис. 2. Изменение плоскости поляризации при прохождении поляризованного света через оптически активные вещества: 1 — оптически активное вещество, 2 — первоначальная плоскость поляризации, повернутая на угол α после прохождения света через оптически активное вещество.
Оптическая (зеркальная) изомерия обусловлена пространственной асимметрией молекул. Такие молекулы при одинаковом химическом строении не могут быть совмещены в пространстве ни при каких поворотах, подобно тому, как нельзя совместить правую и левую руки. Молекулы, обладающие оптической изомерией, как правило, имеют центр асимметрии. Этот центр называют асимметрическим или хиральным. Хиральный центр имеют соединения содержащие атом углерода в состоянии sp 3 -гибридизации, который содержит четыре разных заместителя: Xabcd.
Заметим что, асимметрические центры могут возникать не только у атома углерода, но и у других атомов, например, серы, азота, фосфора, кремния и т.д. Во многих случаях асимметричными являются молекулы комплексных соединений. При этом, в ряде случаев, роль одного из «заместителей» выполняет неподеленная пара электронов.
Пример оптически активного соединения – молочная кислота:
В молекуле молочной кислоты имеется хиральный центр, поэтому существуют два пространственных изомера, являющиеся зеркальными изомерами. Два стереоизомера, относящиеся друг к другу как предмет и его зеркальное отражение, называют антиподами, или энантиомерами. Антиподы отличаются только знаком оптического вращения.
По системе Фишера-Розанова конфигурации оптических изомеров подразделяют на два ряда: D и L. Необходимо помнить, что обозначения D и L не имеют ничего общего с направлением вращения плоскополяризованного света (правовращающий изомер можно обозначить буквой «d», а левовращающий – буквой «l», но не прописными буквами).
Если в стандартной проекционной формуле Фишера ОН-группа (или NH2 для аминокислот) стоит справа, то данный стереоизомер относят к D ряду, если слева, то к L-ряду.
Нечётное количество перестановок (1, 3 …) или поворот на 90° (270 0 ) меняют конфигурацию на противоположную.
Чётное количество перестановок (2, 4 …) или поворот на 180° не меняют конфигурацию.
Взаимная перестановка любых двух групп в проекциях Фишера приводит к превращению энантиомера в его зеркальное отображение:
D,L- номенклатуру продолжают применять для аминокислот, углеводов и многих других природных соединений. Однако данная система имеет ряд недостатков и в настоящее время для описания конфигураций новых соединений не применяется, а вместо нее используют систему Кана-Ингольда-Прелога (R,S-стереохимическая номенклатура).
Для описания абсолютных конфигураций в настоящее время используется система Кана-Ингольда-Прелога (Р. Кан, Д. Ингольд и В. Прелог, 1966) или R-S – система обозначений пространственной конфигурации соединений, в которой R обозначает правый (rectus), а S – левый (sinister). Обозначения R и S помещают в скобках перед названием структуры. Следует понимать, что обозначения абсолютных конфигураций, не связаны какой то зависимостью с физическим явлением — вращением плоскополяризованного луча, то есть знак + или – может стоять у значка R или S. Вместе с тем, изображенная в соответствии с этими правилами абсолютная конфигурация должна точно соответствовать истинному строению данной молекулы, подтвержденному экспериментальными данными.
Возьмем соединение Xabcd содержащее один асимметрический центр X. Чтобы установить его конфигурацию, четыре заместителя у атома X следует пронумеровать и расположить в ряд в порядке уменьшения старшинства 1>2>3>4.
Заместители рассматриваются наблюдателем со стороны, наиболее удаленной от самого младшего заместителя (обозначенного номером 4). Если при этом направление убывания старшинства остальных заместителей (младший не учитывается) 1®2®3 совпадает с движением по часовой стрелке, то конфигурация данного асимметрического центра обозначают символом R, а если против часовой стрелки – символом S.
(данное правило применимо и для анализа других изомеров, где необходимо рассмотреть старшинство заместителей, в частности для анализа конформаций и диастереомеров)
1. Отмечают атомный номер каждого из атомов, непосредственно присоединенных к рассматриваемому асимметрическому атому углерода.
2. Располагают эти атомы в порядке убывания атомного номера. Предпочтение по старшинству отдается атомам с более высокими атомными номерами. Если номера одинаковы (в случае изотопов), то более старшим считается атом с наибольшей атомной массой. Самый младший «заместитель» — неподеленная электронная пара. Таким образом, старшинство возрастает в ряду: неподеленная пара n , где N — число стереоизомеров,а n – число асимметрических атомов.
При рассмотрении 2-фтор-3-хлор-4-бромпентана можно убедиться, что количество изомеров 2 3 равно 8.
Существует четыре стереоизомера для молекул с двумя асимметрическими атомами углерода, которые показаны на рисунке, на примере 3-хлорбутанола-2 -СН 3СНОНСНСlCH3. Возникает ситуация когда молекулы в каждой паре изомеров А и В являются энантиомерами (оптическими изомерами). Если же мы сравним любой из изомеров группы А с любым стереоизомером группы В, то обнаружим, что они не являются зеркальными антиподами. Пространственные изомеры, не являющиеся энантиомерами по отношению друг к другу, называются диастереомерами. σ-Диастереомеры, в отличие от энантиомеров имеют различные физико-химические свойства и, как правило, отличающиеся химические свойства.
Любой из энантиомеров А является диастереомером по отношению к энантиомерам В
Могут реализоваться случаи, когда число изомеров меньше предсказываемого формулой 2 n . Такие случаи встречаются, когда в структуре существуют одинаковые асимметрические центры, то есть центры с одинаковым набором атомов или групп атомов, например, в 2,3-дибромбутане:
Молекулы I и II хиральны. Нетрудно видеть, что проекции III и IV изображают одно и то же соединение: эти проекции полностью совмещаются друг с другом при повороте на 180° в плоскости листа. В проекциях III и IV легко обнаруживается плоскость симметрии, перпендикулярная центральной С-С-связи и проходящая через ее середину. В данном случае проекции III и IV содержат асимметрические центры, но не обладают хиральностью, то есть проекции III и IV это одна и та же молекула, перевернутая на 180°. Вещества, состоящие из таких молекул, называют мезо-формами. Мезо-форма не способна вращать плоскость поляризации света, то есть она оптически неактивна.
Согласно определению, любой из энантиомеров I и II является σ-диастереомером по отношению к мезо-форме, то есть они отличаются физико-химическими и химическими свойствами.
В некоторых случаях для обозначения σ-диастереомеров используются традиционно применяющиеся в стереохимии дескрипторыэритро— и трео-. При этом сравнивают расположение одинаковых заместителей при двух асимметрических атомах в проекции Фишера. Стереоизомеры, в которых одинаковые заместители при асимметрических атомах углерода расположены по одну сторону от вертикальной линии, называют эритро-изомерами. Если такие группы находятся по разные стороны от вертикальной линии, то говорят о трео-изомерах. В изомерах 3-хлорбутанола-2 (I) -(IV) такими реперными группами являются атомы водорода, и эти соединения получают следующие названия:
Приставки эритро— и трео— происходят от названий углеводов: треозы и эритрозы.
В случае соединений с большим числом асимметрических центров иногда применяют другие стереохимические дескрипторы, также происходящие от названий углеводов (рибо-, ликсо-, глюко— и т.п.).
Геометрическая изомерия – это стереоизомерия, обусловленная различным расположением заместителей вокруг двойных связей. Если оба заместителя располагаются по одну сторону от двойной связи, то это цис-изомер, если по разные строны, то это транс-изомер. Транс-измеры энергетически более устойчивы вследствие наименьшего взаимного отталкивания заместителей. Отметим, что геометрических изомеров не образуют соединения у который двойная связь располагается у концевого атома углерода. Пример:
Сложнее ситуация когда в алкене различные заместители. В современной номенклатуре правила последовательного старшинства применимы также и к описанию геометрических изомеров непредельных соединений. Заместители у каждого конца кратной связи при установлении старшинства должны рассматриваться отдельно. Если заместители, имеющие более высокое старшинство, расположены с одной и той же стороны двойной связи, соединению присваивают префикс Z (от немецкого zusammen – вместе), а если по разным сторонам, то префикс E (entgegen – напротив).
Z, E-Номенклатура распространена и на прочие геометрические изомеры, в которых π-диастереомерия определяется наличием C=N –связи или к примеру C=P-связи. В качестве четвертого заместителя рассматривают n-электроны на атоме азота (нольвалентный заместитель).
Цис,транс-изомерия, а также и син,анти-изомерия распространена в химии не только на соединения с кратными связями, но и на циклические и каркасные соединения.
Молекулы промышленно важного углеводорода А (DH2 = 13) в присутствии катализаторов образуют различные олигомеры:
Из углеводородов А и В были получены изомерные углеводороды I–VI согласно приведенной ниже схеме превращений:
2. Напишите структурные формулы I–V, F–О. чтите, что превращения F в G и K в L – изомеризации. Помните, что разные буквы не могут обозначать одно и то же вещество.
Химикам уже давно известно явление изомерии — когда два вещества имеют одну и ту же брутто-формулу (отражающую только количество разных атомов в веществе), но разные свойства — из-за разного порядка соединения атомов.
Особенно богата изомерами органическая химия. К примеру, этиловый спирт и диметиловый эфир имеют одну и ту же брутто-формулу: C2H6O, но структурная формула спирта — CH3–CH2–OH, а эфира — CH3–O–CH3. Эти вещества имеют разные свойства — как химические, так и физические (температура плавления, вязкость и т. д.).
В органической химии известны и так называемые оптические изомеры — молекулы, имеющие одинаковую структурную формулу, но не совместимые со своим зеркальным отражением. Простейший пример такой молекулы — это атом углерода с четырьмя разными заместителями. К примеру, СHClBrF или аланин CH3CHNH2COOH (рис. 1). Наличие у такой молекулы двух разных конфигураций связано с тем, что у атома углерода, образующего четыре одинарные связи, эти связи направлены к вершинам тетраэдра.
Оптические изомеры имеют одинаковый цвет, температуру кипения, плотность. Однако такие вещества обладают интересным физическим свойством — они вращают плоскость поляризации пропущенного через них поляризованного света. Один изомер будет вращать ее влево, другой — вправо.
Атом углерода с четырьмя разными заместителями называется хиральным атомом (от греческого heiros «ладонь» — тот же корень, что и в слове «хиромантия»). Чем больше хиральных атомов в молекуле, тем больше у вещества может быть оптических изомеров.
Интересно, что возможны органические вещества, которые имеют оптические изомеры, хотя в них формально нет ни одного хирального атома — центра изомерии.
Приведите пример органического вещества, не имеющего хиральных атомов, но при этом имеющего оптические изомеры, с минимальным количеством атомов углерода.
Для того чтобы молекула некоторого вещества не совпадала со своим зеркальным отражением, совершенно не обязательно, чтобы у нее был хотя бы один хиральный атом. К примеру, любая молекула в форме спирали будет оптически активной.
Кроме того, вспомните, к вершинам какой геометрической фигуры направлены четыре связи в хиральном атоме углерода.
Начнем с того, что для несовместимости со своим зеркальным отражением молекуле недостаточно быть просто несимметричной. Молекула может быть не равна своему отражению «на бумаге», но совместима с ним. Скажем, молекулу HCl мы можем просто повернуть (или посмотреть на нее с другой стороны). Мы можем также вращать части молекулы вокруг одинарных связей — а вот с двойными и тройными связями так поступать нельзя, они при этом рвутся.
Итак, если структура молекулы имеет такую пространственную асимметрию, что она не совмещается со своим зеркальным отражением, то молекула и ее отражение называются оптическими изомерами. Наша цель — попробовать придумать структуру, которая бы была несовместима со своим зеркальным отражением, имела бы минимальное количество атомов углерода, и при этом сами эти атомы не были бы хиральными центрами молекулы.
На первый взгляд, такой молекулой могли бы быть замещенные этилены, где вместо атомов водорода — четыре разных заместителя:
Однако несмотря на то, что у такого вещества есть изомеры (два произвольно выбранных заместителя у разных атомов углерода могут располагаться по одну сторону двойной связи или по разные), хиральными они не будут, так как молекулы с одной двойной связью — плоские; чтобы совместить их со своим зеркальным отражением, их достаточно просто повернуть на 180° вокруг оси, лежащей в плоскости молекулы и перпендикулярной двойной связи.
Существует вариант с тремя атомами углерода, который формально уже можно назвать решением нашей задачи. Четырехзамещенные аллены RR’C=C=CR»R»’ тоже содержат двойные связи, но их молекулы уже не плоские. Дело в том, что если у одного атома углерода есть две двойные связи, то их плоскости повернуты друг относительно друга на 90 градусов:
Эта молекула уже хиральна, и можно сказать, что задачу мы решили. Однако в ней есть «хиральный центр» — центральный атом углерода. Попробуем решить задачу другим способом.
Три атома углерода можно расположить по-другому — создав из них треугольник. У нас получится вещество циклопропан, С3H6:
Это хорошо известное вещество, которое до сих пор иногда используется в медицине в качестве средства для наркоза. Атомы углерода образуют жесткую плоскость. Каждый из них связан с двумя атомами водорода — один над плоскостью, другой — под ней.
Теперь заменим у двух атомов углерода по одному атому водорода на два других заместителя — к примеру, хлор и бром — так, чтобы они оказались по разные стороны от плоскости атомов углерода. Такое положение заместителей называется транс-изомером 1,2-дизамещенного циклопропана. (Если бы эти заместители располагались по одну сторону от плоскости, у нас получился бы цис-изомер, но он нас сейчас не интересует).
Внимательно посмотрим на получившуюся молекулу и представим себе ее зеркальное отражение:
Обе структуры, как бы мы ни крутили их в пространстве, друг с другом не совмещаются, а атома — хирального центра тут нет.
А теперь попробуем создать полный аналог хирального атома углерода — но без хирального центра. Вернемся к первоначальному атому, с которого мы начали (см. условие задачи). Четыре связи его направлены к вершинам тетраэдра. Давайте попробуем расположить по атому углерода в его вершинах и соединить их связями.
У нас получится углеродный скелет вещества C4H4 — тетраэдрана. Само это вещество еще не получено химиками, но его производные уже существуют в реальности. Если заместить в нём все атомы водорода на разные заместители, то получится вполне себе хиральная молекула, «хиральный центр» которой будет располагаться внутри тетраэдра:
Тема изомерии — одна из самых благодатных тем для игры ума. Даже в школьных олимпиадах по химии очень часто можно встретить задания с просьбой написать все изомеры того или иного вещества (иногда сами составители задач чего-то не рассчитывают, и на решение уходит много времени и очень много бумаги; у автора этой задачи на районной олимпиаде как-то ушло полтора часа и целая тетрадка).
Оптические изомеры — всего один из вариантов изомерии в органической химии, но очень важный.
К примеру, все основные аминокислоты, которые входят в состав наших белков, имеют формулу H2N–CH(R)–COOH — то есть все (кроме глицина, у которого R тоже представляет собой атом водорода) имеют асимметрический атом углерода и имеют оптические изомеры. И в нашем организме встречаются почти исключительно L-изомеры аминокислот (если не вдаваться в тонкости номенклатуры хиральных атомов, которых существует целых три типа, то можно назвать эти молекулы «левыми»). И биохимики до сих пор гадают, почему природа выбрала именно этот изомер — ведь при всех реакциях, когда из более простых веществ получаются вещества с хиральным атомом (без присутствия специфических катализаторов) образуется смесь двух изомеров в равных частях.
Синтетики тоже любят «поиграть» с оптической изомерией и при этом уже создали множество веществ без хирального атома — но с оптической активностью.
Кстати, можно создать хиральную молекулу вообще без заместителей. И она будет достаточно небольшой. Существуют так называемые ароматические углеводороды. Самый простой из них — бензол, C6H6. Его структуру учат в школе — плоский шестигранник. Вещество посложнее — нафталин. Это уже два соединенных по одной стороне бензольных кольца:
Три кольца можно уже соединять в линию — получится антрацен, а можно — под углом, и тогда у нас получится фенантрен:
Так вот, если продолжать соединять кольца под углом и дойти до шести колец, то крайние кольца упрутся друг в друга, им не хватит места, и плоскость молекулы нарушится. Вещество из шести колец называется гексагелицен, и его молекула уже представляет собой спираль. А значит, эта молекула может быть либо левой спиралью, либо правой, и будет иметь оптические изомеры.
Кстати, химики научились получать такие спирали даже из 12 бензольных колец, в них уже есть пара витков.
Более того, и оптическими изомерами весь ассортимент разнообразия химических веществ, как ни странно, не заканчивается.
Стоит сказать о возможности так называемой топологической изомерии. Что это такое? К примеру, существует вещество в форме кольца. Две молекулы этого вещества изомерны одной, в которой одно кольцо продето в другое. И такие молекулы уже есть. Класс веществ, в которых две или более частей молекул удерживаются механически, как звенья цепи, называются катенанами — от латинского catena «цепь» (см. Catenane). Биохимики научились получать катенаны из молекул ДНК, и более короткие структуры тоже складывали в цепочки.
А если представить себе катенан из четырех колец, то возможна изомерия между молекулой, в которой три кольца продеты в четвертое, и молекулой, в которых кольца соединены последовательно.
Изомер и я (от изо. и греч. m é ros — доля, часть) химических соединений, явление, заключающееся в существовании веществ, одинаковых по составу и молекулярной массе, но различающихся по строению или расположению атомов в пространстве и вследствие этого по физическим и химическим свойствам. Такие вещества называются изомерами.
Изомерия открыта в 1823 Ю. Либихом, показавшим, что серебряная соль гремучей кислоты Ag — О — N = C и изоцианат серебра Ag — N = C = O имеют один и тот же состав, но совершенно разные свойства. Термин «изомерия» предложен в 1830 И. Берцелиусом. Особенно распространена изомерия среди органических соединений. Явление изомерии было успешно объяснено теорией химического строения, разработанной в 60-х гг. 19 в. А. М. Бутлеровым.
Различают два основных вида изомерии: структурную и пространственную (стереоизомерию). Структурные изомеры отличаются друг от друга порядком связей между атомами в молекуле; стереоизомеры — расположением атомов в пространстве при одинаковом порядке связей между ними.
Структурная изомерия подразделяется на несколько разновидностей. Изомерия скелета обусловлена различным порядком связи между атомами углерода, образующими скелет молекулы. Так, может существовать только один нециклический насыщенный углеводород с тремя атомами С — пропан (I). Углеводородов такого же типа с четырьмя атомами С может быть уже два: н-бутан (II) и изобутан (III), а с пятью атомами С — три: н-пентан (IV), изопентан (V) и неопентан (VI):
Изомерия положения обусловлена различным положением какой-либо реакционноспособной группы (функциональной группы, заместителя) при одинаковом углеродном скелете молекул. Так, пропану соответствуют два изомерных спирта: н-пропиловый (VII) и изопропиловый (VIII):
Важную роль играет изомерия положения у соединений ароматического ряда, так как положение заместителей в бензольном ядре — один из главных факторов, определяющих реакционную способность вещества. Например, о-динитробензол (IX) и n-динитробензол (X) легко реагируют с аммиаком, тогда как м-динитробензол (XI) в реакцию с NH3 не вступает.
В ряду алифатических простых эфиров, сульфидов и аминов существует специальный вид изомерии — метамерия, обусловленная различным положением гетероатома в углеродной цепи. Метамерами являются, например, метилпропиловый (XII) и диэтиловый (XIII) эфиры:
Термин «метамерия» применяется всё реже.
Изомерия непредельных соединений может быть вызвана различным положением кратной связи, как, например, в бутене-1 (XIV) и бутене-2 (XV), в винилуксусной (XVI) и кротоновой (XVII) кислотах:
В большинстве случаев структурные изомеры сочетают признаки изомерии скелета и изомерии положения, содержат различные функциональные группы и принадлежат к разным классам веществ, вследствие чего они отличаются друг от друга значительно больше, чем рассмотренные выше изомеры веществ одного и того же типа. Например, изомерами являются пропилен (XVIII) и циклопропан (XIX), окись этилена (XX) и ацетальдегид (XXI), ацетон (XXII) и пропионовый альдегид (XXIII), диметиловый эфир (XXIV) и этиловый спирт (XXV), аллен (XXVI) и метилацетилен (XXVII):
Особым видом структурной изомерии является таутомерия (равновесная динамическая изомерия) — существование вещества в двух или более изомерных формах, легко переходящих друг в друга. Так, ацетоуксусный эфир существует в виде равновесной смеси кетонной (XXVIII) и енольной (XXIX) форм:
Пространственная изомерия подразделяется на два вида: геометрическую изомерию (или цис-транс-изомерию) и оптическую изомерию. Геометрическая изомерия свойственна соединениям, содержащим двойные связи (С = С, C = N и др.), и неароматическим циклическим соединениям; она обусловлена невозможностью свободного вращения атомов вокруг двойной связи или в цикле. В этих случаях заместители могут быть расположены либо по одну сторону плоскости двойной связи или цикла (цис-положение), либо по разные стороны (транс-положение). Понятия «цис» и «транс» обычно относят к паре одинаковых заместителей, а если все заместители разные, то условно к одной из пар. Примерами геометрических изомеров могут служить две формы этилен-1,2-дикарбоновой кислоты — цис-форма, или малеиновая кислота (XXX), и транс-форма, или фумаровая кислота (XXXI), а также цис- и транс-формы циклопропан-1,2-дикарбоновой кислоты (соответственно XXXII и XXXIII):
Для обозначения изомерных соединений, содержащих связи C = N или N = N, часто вместо цис и транс применяют термины соответственно син и анти. Так, в молекуле син-бензальдоксима (XXXIV) атом водорода при углероде и гидроксильная группа при азоте расположены по одну сторону плоскости, проходящей через C = N-cвязь, а в молекуле анти-бензальдоксима (XXXV) — по разные стороны этой плоскости:
Геометрические изомеры обычно существенно различаются по физическим свойствам (температурам кипения и плавления, растворимости, дипольным моментам, термодинамической устойчивости и др.). В таблице приведены некоторые свойства геометрических изомеров — малеиновой и фумаровой кислот.
Некоторые физические свойства малеиновой и фумаровой кислот
Для непредельных соединений возможны переходы цис-формы в транс-форму и обратно; так, под воздействием небольших количеств йода, галогеноводородов или других реагентов менее устойчивая, лабильная, форма переходит в более стабильную, тогда как облучение ультрафиолетовым светом способствует обратному превращению. Геометрические изомеры различаются и некоторыми химическими свойствами. Так, малеиновая кислота, у которой карбоксильные группы пространственно сближены, легко образует малеиновый ангидрид
Оптическая изомерия свойственна молекулам органических веществ, не имеющим плоскости симметрии (плоскости, разделяющей молекулу на две зеркально тождественные половины) и не совмещающимся со своим зеркальным отображением (т. е. с молекулой, соответствующей этому зеркальному отображению). Такие асимметричные молекулы обладают оптической активностью — способностью к вращению плоскости поляризации света при прохождении поляризованного луча через кристалл, расплав или раствор вещества.
Оптической активностью обладают кристаллы некоторых неорганических веществ, например кварца, однако оптическая активность в этом случае обусловлена асимметрией кристаллической решётки и исчезает при переходе вещества в другие агрегатные состояния. Оптическая изомерия органических веществ зависит только от строения молекул и с агрегатным состоянием не связана. Голландский химик. Я. Вант-Гофф впервые предложил (1874) объяснение оптической активности на основе тетраэдрической модели атома углерода.
Чаще всего оптическая активность обусловлена наличием в молекуле асимметричного атома углерода, т. е. атома углерода, связанного с четырьмя различными заместителями. Примером может служить молочная кислота: CH3C * H(OH)COOH (асимметрический атом углерода отмечен звёздочкой). Согласно тетраэдрической модели атома углерода, заместители располагаются в углах правильного тетраэдра, в центре которого находится атом углерода:
Как видно из приведённых формул, молекула молочной кислоты ни при каком перемещении в пространстве не может совпасть со своим зеркальным отображением. Эти две формы кислоты относятся друг к другу, как правая рука к левой, и называются оптическими антиподами (энантиомерами).
Все химические свойства оптических антиподов идентичны; одинаковы и их физические свойства, за исключением оптической активности: одна форма вращает плоскость поляризации света влево [l-или (—)-форма], другая — на тот же по величине угол вправо [d-или (+)-форма]. Ясно, что две формы одного и того же вещества с противоположными знаками вращения имеют зеркально-противоположные конфигурации. Одинаковый знак вращения разных веществ не служит доказательством сходства их конфигураций, а вещества с противоположным знаком вращения могут иметь одинаковые конфигурации, как, например, левовращающая молочная кислота и её правовращающие эфиры.
Для обозначения генетической связи веществ применяют знаки L и D, показывающие конфигурационное родство определённого оптически активного вещества с L-или D-глицериновым альдегидом или соответственно с L-или D-глюкозой. Левовращающая молочная кислота оказывается принадлежащей к D-pяду и обозначается как D-(—)-молочная кислота, правовращающая — к L-pяду и обозначается как L-(+)-moлочная кислота.
Смесь равных количеств оптических антиподов ведёт себя как индивидуальное химическое соединение, лишённое оптической активности и сильно отличающееся по физическим свойствам от каждого из антиподов. Такое вещество называется рацемическим соединением, или рацематом [d, l- или (±)-форма]. При всех химических превращениях, при которых образуются новые асимметричные атомы углерода, всегда получаются рацематы, так как вероятности образования правовращающей и левовращающей форм равны.
В случае соединений типа abcC’ — C’’def, содержащих два асимметричных центра, возможны следующие четыре изомера соответственно конфигурации асимметричных атомов C’ и С’’: левый — левый (I), левый — правый (II), правый — правый (III) и правый — левый (IV):
(А и В обозначают соответственно атомы C’ и С’’).
Формы I и III, II и IV — оптические антиподы. Формы I и II, I и IV, II и III не являются антиподами, так как конфигурации одного асимметричного центра у них противоположны, а другого совпадают. Такие оптические изомеры называются диастереоизомерами, или диастереомерами. Диастереомеры резко различаются по всем важнейшим физическим свойствам. Если же заместители при двух асимметричных центрах одинаковы, т. е. в случае соединений типа abc — C’ — С’’ — abc [например, винные кислоты НООСС * Н(ОН)C * H(ОН)СООН], формы II и IV совпадут и дадут оптически недеятельную форму (мезо-форму), так как оптическая активность одного центра (C’) компенсируется равной по величине и противоположной по знаку активностью другого центра (С’’).
Рацемические соединения могут быть расщеплены на оптические антиподы. Для этого обычно используют реакции с оптически активными веществами.
Оптическая изомерия играет важнейшую роль в биологических процессах. Оптически активными являются природные аминокислоты, углеводы, алкалоиды и др.
Оптическая изомерия циклических соединений тесно связана с геометрической изомерией; так, транс- форма дизамещённого циклического соединения (например, XXXIII) не совпадает со своим зеркальным отображением.
Химическими методами можно определить относительную конфигурацию вещества, т. е. принадлежность его к D- или L-ряду. Вопрос же об абсолютной конфигурации, т. е. о действительном расположении заместителей в пространстве вокруг асимметричного центра, решается физическими методами — на основании данных дисперсии оптического вращения и рентгеноструктурного анализа. Оптическая изомерия может быть обусловлена не только наличием асимметричных атомов, но и асимметрией молекулы в целом, как, например, у замещенных алленов и спиранов:
У производных дифенила, имеющих объёмистые заместители в орто-положении, возможно существование оптических изомеров вследствие затруднённости вращения бензольных колец:
Данный вид оптической изомерии называется атропоизомерией (по существу, это частный случай поворотной изомерии).
Поворотная изомерия обусловлена ограниченным вращением в молекуле атомов или групп атомов вокруг углерод-углеродной (или любой другой) простой связи. Геометрические формы, которые принимает при этом молекула, называются конформациями, а соответствующие структуры — конформерами (конформационными, вращательными, или поворотными изомерами). Существование предпочтительных конформаций связано с взаимодействием валентно не связанных между собой атомов и групп атомов. Теоретически молекула может принимать бесчисленное множество конформаций, однако реализуются обычно немногие, выгодные энергетически. Например, из всех возможных конформаций этана энергетически наиболее выгодна заторможенная конформация (а), наименее — заслонённая (б):
(заторможенная конформация обладает минимальной энергией, заслонённая — максимальной; у большинства соединений устойчивыми формами являются заторможенные конформации). Разность энергий между конформациями а и б составляет 11,7 кдж/моль (2,8 ккал/моль); это энергетический барьер вращения вокруг связи С—С в этане, т. е. энергия, необходимая для перехода из одной устойчивой (заторможенной) конформации в другую. При вращении групп CH3 на 360° друг относительно друга молекула этана трижды принимает каждую из указанных конформации. В этане все три устойчивые конформации идентичны. Для замещенных этанов, например для 1,2-дихлорэтана, они уже не все равноценны (возможны две заторможенные конформации и одна заслонённая). Так, трансоидная конформация (в) выгоднее скошенной, или гош-конформации (г), на 5,02 кдж/моль (1,2 ккал/моль), разность же между энергиями трансоидной (в) и заслонённой (д) конформации составляет 20,93 кдж/моль (5 ккал/моль):
За исключением рассмотренного выше случая атропоизомерии, энергетические барьеры конформационных переходов недостаточно велики, чтобы поворотные изомеры можно было выделить, однако их можно наблюдать, например, методами инфракрасной спектроскопии и особенно ядерного магнитного резонанса (часто только при пониженной температуре). Исследование конформационных состояний имеет большое значение при изучении физико-химических свойств веществ и их реакционной способности. См. Конформационный анализ.
Лит.: Илиел Э., Стереохимия соединений углерода, пер. с англ., М., 1965; Терентьев А. П., Потапов В. М., Основы стереохимии, М.—Л., 1964.
ОПТИЧЕСКАЯ ИЗОМЕРИЯ. «Когда молекула смотрится в зеркало» такое необычное название было у статьи, опубликованной в июньском номере за 1996 год американского журнала, посвященного химическому образованию (Journal of Chemical Education). А на первой странице обложки этого номера был тоже необычный рисунок. На боку добродушно виляющего хвостом пса была изображена структурная формула пеницилламина. Пес смотрел в зеркало, а оттуда на него глядел страшный зверь с оскаленной клыкастой пастью и вставшей дыбом шерстью. На боку зверя была изображена та же самая структурная формула в виде зеркального отображением первой. Почему же фактически одно и то же вещество имеет столь разные обличья? Объясняется это особым свойством некоторых химических соединений, которое тесно связано с их оптической активностью.
В начале 19 в. английский физик, астроном и врач Томас Юнг показал, что свет можно рассматривать как волну. Французский физик Огюстен Френель установил, что световые волны поперечные: колебания в них происходят перпендикулярно направлению движения (как у волн на поверхности воды: волна бежит вперед, а поплавок на воде колеблется вверх вниз). Уже в 20 в. было установлено, что свет это электромагнитная волна, наподобие радиоволны, только длина волны у света намного меньше. Термин «электромагнитная» означает, что у света имеются электрические и магнитные поля, которые совершают периодические колебания, как волны на поверхности моря. Нас сейчас интересуют колебания только электрического поля. Оказывается, эти колебания происходят не как попало, а только перпендикулярно направлению светового луча. В обычном свете (его излучают, например, солнце, лампы накаливания) колебания происходят случайно, во всех направлениях. Но, пройдя через некоторые кристаллы, например, турмалина или исландского шпата (прозрачная разновидность кальцита СаСО3), свет приобретает особые свойства: кристалл как бы «срезает» все колебания электрического поля, кроме одного, расположенного в определенной плоскости. Образно говоря, луч такого света подобен шерстяной нитке, которую продернули через узкую щель между двумя острыми лезвиями бритвы.
Французский физик Этьен Луи Малюс полагал, что свет состоит из частиц с двумя полюсами «северным» и «южным», и в свете, прошедшем через исландский шпат, все полюсы повернуты в одну сторону. Поэтому он назвал такой свет поляризованным. Было обнаружено, что свет частично поляризуется, отражаясь под некоторыми углами от блестящих поверхностей диэлектриков, например, от стекла, или преломляясь в них. Теория Малюса не подтвердилась, однако название осталось. Глаз человека не может отличить обычный свет от поляризованного, однако это легко сделать с помощью простейших оптических приборов поляриметров; ими пользуются, например, фотографы: поляризационные фильтры помогают избавиться от бликов на фотографии, которые возникают при отражении света от поверхности воды.
Выяснилось, что при прохождении поляризованного света через некоторые вещества происходит интересное явление: плоскость, в которой расположены «стрелки» колеблющегося электрического поля, постепенно поворачивается вокруг оси, вдоль которой идет луч. Впервые это явление обнаружил в 1811 французский физик Франсуа Доминик Араго у кристаллов кварца. Природные кристаллы кварца имеют неправильное, асимметричное строение, причем они бывают двух типов, которые отличаются по своей форме, как предмет от своего зеркального изображения. Эти кристаллы вращают плоскость поляризации света в противоположных направлениях; их назвали право- и левовращающими.
В 1815 другой французский физик Жан Батист Био и немецкий физик Томас Зеебек установили, что некоторые органические вещества (например, сахар или скипидар) также обладают этим свойством, причем не только в кристаллическом, но и в жидком, растворенном и даже газообразном состоянии. Так было доказано, что оптическая активность может быть связана не только с асимметрией кристаллов, но и с каким-то неизвестным свойством самих молекул. Оказалось, что, как и в случае кристаллов, некоторые химические соединения могут существовать в виде как право-, так и левовращающих разновидностей, причем самый тщательный химический анализ не обнаруживает между ними никаких различий! Фактически это был новый тип изомерии, которую назвали оптической изомерией. Оказалось, что кроме право- и левовращающих, есть и третий тип изомеров оптически неактивные. Это обнаружил в 1830 знаменитый немецкий химик Йёнс Якоб Берцелиус на примере виноградной (дигидроксиянтарной) кислоты НООССН(ОН)СН(ОН)СООН: эта кислота оптически неактивна, а винная кислота точно такого же состава обладает в растворе правым вращением. Позднее была открыта и не встречающаяся в природе «левая» винная кислота антипод правовращающей.
Различить оптические изомеры можно с помощью поляриметра прибора, измеряющего угол поворота плоскости поляризации. Для растворов этот угол линейно зависит от толщины слоя и концентрации оптически активного вещества (закон Био). Для разных веществ оптическая активность может изменяться в очень широких пределах. Так, в случае водных растворов разных аминокислот при 25° С удельная активность (она обозначается как [ a ]D и измеряется для света с длиной волны 589 нм при концентрации 1 г/мл и толщине слоя 10 см) равна 232° для цистина, 86,2° для пролина, 11,0° для лейцина, +1,8° для аланина, +13,5° для лизина и +33,2° для аспарагина. Современные поляриметры позволяют измерять оптическое вращение с очень высокой точностью (до 0,001°). Подобные измерения позволяют быстро и точно определить концентрацию оптически активных веществ, например, содержание сахара в растворах на всех стадиях его производства начиная от сырых продуктов и кончая концентрированным раствором и патокой.
Оптическую активность кристаллов физики связывали с их асимметричностью; полностью симметричные кристаллы, например, кубические кристаллы поваренной соли оптически неактивны. Причина же оптической активности молекул долгое время оставалась совершенно загадочной. Первое открытие, проливавшее свет на это явление, сделал в 1848 никому тогда не известный Луи Пастер. Еще в студенческие годы Пастер интересовался химией и кристаллографией, работая под руководством физика Ж.Б.Био и видного французского химика Жана Батиста Дюма. После окончания Высшей нормальной школы в Париже молодой (ему было всего 26 лет) Пастер работал лаборантом у Антуана Балара. Балар был уже известным химиком, который за 22 года до этого прославился открытием нового элемента брома. Своему ассистенту он дал тему по кристаллографии, не предполагая, что это приведет к выдающемуся открытию.
В ходе исследования Пастер получил кислую натриевую соль виноградной кислоты C4H5O6Na, насытил раствор аммиаком и медленным выпариванием воды получил красивые призматические кристаллы натриево-аммониевой соли C4H3O6NaNH4. Кристаллы эти оказались асимметричными, одни из них были как бы зеркальным отражением других: у половины кристаллов одна характерная грань находилась справа, а у других слева. Вооружившись увеличительным стеклом и пинцетом, Пастер разделил кристаллы на две кучки. Их растворы, как и следовало ожидать, обладали противоположным оптическим вращением. Пастер на этом не остановился. Из каждого раствора он выделил исходную кислоту (которая была неактивной). Каково же было его удивление, когда оказалось, что один раствор это известная правовращающая винная кислота, а другой такая же кислота, но вращающая влево!
Воспоминания очевидцев свидетельствуют о невероятном нервном возбуждении молодого ученого, охватившем его в эту минуту; поняв, что ему удалось сделать, Пастер выбежал из лаборатории и, встретив лаборанта физического кабинета, бросился к нему и, обняв, воскликнул: «Я только что сделал великое открытие!» А заключалось оно в том, что давно известная неактивная виноградная кислота это просто смесь равных количеств также известной «правой» винной кислоты и ранее не известной «левой». Именно поэтому смесь не обладает оптической активностью. Для такой смеси стали применять название рацемат (от латинского racemus виноград). А два полученных Пастером антипода винной кислоты получили название энантиомеров (от греч. enantios противоположный). Пастер ввел для них обозначения L- и D-изомеров (от латинских слов laevus левый и dexter правый). Позднее немецкий химик Эмиль Фишер связал эти обозначения со строением двух энантиомеров одного из наиболее простых оптически активных веществ глицеринового альдегида ОНСН2СН(ОН)СНО. В 1956 по предложению английских химиков Роберта Кана и Кристофера Ингольда и швейцарского химика Владимира Прелога для оптических изомеров были введены обозначения S (от лат. sinister левый) и R (лат. rectus правый); рацемат обозначают символом RS. Однако по традиции широко используются и старые обозначения (например, для углеводов, аминокислот). Следует отметить, что эти буквы указывают лишь на строение молекулы («правое» или «левое» расположение определенных химических групп) и не связаны с направлением оптического вращения; последнее обозначают знаками плюс и минус, например, D()-фруктоза, D(+)-глюкоза.
Кроме «ручного способа», Пастер открыл еще два метода разделения рацемата на два антипода. Биохимический метод основан на избирательной способности некоторых микроорганизмов усваивать только один из изомеров. Например, грибковая плесень Penicillum glaucum, растущая на разбавленных растворах виноградной кислоты или ее солей, «поедает» только правый изомер, оставляя левый без изменения.
Третий способ разделения рацематов был чисто химический. Но для него требовалось заранее иметь оптически активное вещество, которое при взаимодействии с рацемической смесью, «выбирало» бы из нее только один энантиомер. Например, оптически активное органическое основание давало с виноградной кислотой оптически активную соль, из которой можно было выделить соответствующий энантиомер винной кислоты.
Работа Пастера, доказывающая возможность «расщепления» оптически неактивного соединения на антиподы энантиомеры, первоначально вызвала у многих химиков недоверие. Даже сам Био не поверил своему ассистенту, пока собственноручно не повторил его опыт не убедился в правоте Пастера. Эта и последующие работы Пастера приковали к себе пристальное внимание химиков. Вскоре Жозеф Ле Бель с помощью третьего пастеровского метода расщепил несколько спиртов на оптически активные антиподы. Иоганн Вислиценус установил, что существуют две молочные кислоты: оптически неактивная, образующаяся в скисшем молоке (молочная кислота брожения), и правовращающая, которая появляется в работающей мышце (мясомолочная кислота). Подобных примеров становилось все больше, и требовалась теория, объясняющая, чем же отличаются друг от друга молекулы антиподов. Такую теорию создал молодой голландский ученый Вант-Гофф. Согласно этой теории, молекулы, как и кристаллы, могут быть «правыми» и «левыми», являясь зеркальным отражением друг друга. Простейший пример был такой. Атом углерода в органических соединениях четырехвалентен, четыре химические связи направлены от него под равными углами к вершинам тетраэдра. Если все атомы или группы атомов, находящиеся в вершинах тетраэдра и связанные с центральным атомом углерода, будут разными, то возможны две разные структуры, которые не совмещаются друг с другом вращением в пространстве. Если же хотя бы два заместителя из четырех будут одинаковыми, молекулы станут полностью идентичными (это легко проверить с помощью модели из спичек и цветного пластилина). Подобные структуры, которые отличаются друг от друга как правая рука от левой, получили название хиральных (от греч. heir рука). Таким образом, оптическая активность следствие пространственной изомерии (стереоизомерии) молекул.
Атом углерода, связанный с четырьмя различными заместителями, называется асимметрическим. Асимметрическими могут быть и атомы других элементов кремния, азота, фосфора, серы. Однако оптически активными могут быть и соединения без асимметрических атомов углерода, если они могут существовать в виде двух зеркальных изомеров. Молекула будет асимметрической, если в ней нет ни одного элемента симметрии ни центра, ни осей, ни плоскости симметрии. Примером может служить молекула аллена H2C=C=CH2, в которой имеются два различных заместителя: R1R2C=C=CR1R2. Дело в том, что эти заместители находятся не в одной плоскости (как, например, у алкенов), а в двух взаимно перпендикулярных плоскостях. Поэтому возможно существование двух зеркальных изомеров, которые никакими перемещениями и поворотами невозможно совместить друг с другом.
Более сложные отношения встречаются в случае молекул с несколькими асимметрическими атомами углерода. Например, в винной кислоте две гидроксильные группы у двух соседних атомов углерода могут быть расположены так, что молекула окажется симметричной и зеркальных изомеров у нее не будет. Это приводит к образованию еще одного, оптически неактивного, изомера, которых называется мезовинной (или антивинной) кислотой. Таким образом, дигидроксиянтарная кислота может находиться в виде четырех изомеров: правовращающего (D-винная кислота, которую в медицине называют виннокаменной), левовращающего (L-винная кислота), оптически неактивного (мезовинная кислота), а также в виде смеси L- и R-изомеров, то есть рацемата (i-винная, или виноградная кислота). Оптически активные винные кислоты при длительном нагревании их водных растворов рацемизуются, превращаясь в смесь антиподов.
Еще сложнее обстоит дело, когда асимметрических центров у молекулы множество. Например, в молекуле глюкозы их четыре. Поэтому для нее теоретически возможно существование 16 стереоизомеров, которые образуют 8 пар зеркальных антиподов. Они давно известны химикам; это сама глюкоза, а также аллоза, альтроза, манноза, гулоза, идоза, галактоза и талоза. Многие из них встречаются в природе, например, D-глюкоза (но не L-глюкоза, которая была получена синтетически).
Если в веществе поровну «правых» и «левых» молекул, оно будет оптически неактивным. Именно такие вещества и получаются в колбе в результате обычного химического синтеза. И только в живых организмах, при участии асимметричных агентов (например, ферментов) образуются оптически активные соединения. Конечно, тут же возник вопрос о том, как же появились на Земле такие соединения, например, та же природная правовращающая винная кислота, или «асимметричные» микроорганизмы, питающиеся только одним из энантиомеров. Ведь в отсутствие человека некому было осуществлять направленный синтез оптически активных веществ, некому было разделять кристаллы на правые и левые! Однако подобные вопросы оказались настолько сложными, что ответа на них нет и поныне. Например, никто не знает, почему почти все природные аминокислоты, из которых построены белки, относятся к L-ряду (S-конфигурация), а их антиподы только изредка встречаются у некоторых антибиотиков.
Теория Вант-Гоффа далеко не сразу завоевала признание. Так, выдающийся немецкий химик-экспериментатор Адольф Кольбе, (его именем названо несколько органических реакций), опубликовал в мае 1877 года язвительную статью, в которой резко отрицательно отозвался о новой теории. К счастью, Кольбе оказался в явном меньшинстве, и теория Вант-Гоффа, заложившая основы современной стереохимии, завоевала общее признание, а ее создатель в 1901 стал первым лауреатом Нобелевской премии по химии.
Эта теория позволила объяснить многие химические явления. Например, в реакциях замещения атомов галогенов на гидроксильные группы: в оптически активных алкилгалогенидах RX + OH ® ROH + X (X атом галогена) в некоторых случаях оптическая активность исчезает, в других сохраняется, но меняет знак. Оказалось, что эта реакция может идти разными путями. Первый механизм включает диссоциацию галогенида с образованием промежуточных ионов R + , которые быстро соединяются с анионами ОН , давая продукт реакции спирт. Если исходный галогенид RX имел оптическую активность, она в результате этой реакции теряется, поскольку гидроксил может подойти к промежуточному плоскому катиону с любой стороны, так что образуется смесь энантиомеров. Если же реакция идет по второму механизму, анион OH, подходит к атому углерода со стороны, противоположной связи CX, и «вытесняет» атом галогена в виде аниона. Если исходный галогенид R1R2R3CX имел оптическую активность, она в результате этой реакции сохраняется, но знак оптического вращения меняется на противоположный. Происходит это потому, что три заместителя у асимметрического атома углерода R1, R2 и R3, находящиеся, как и атом галогена, в вершинах тетраэдра, при подходе атакующего агента гидроксила меняют свою конфигурацию относительно четвертого заместителя; такое изменение конфигурации аналогично выворачиванию зонтика на сильном ветру.
Химики часто относятся к энантиомерам, как к одному соединению, поскольку их химические свойства идентичны. Однако их биологическая активность может быть совершенно различной. Это стало очевидным после трагической истории с талидомидом лекарственным средством, которое в 60-е годы 20 в. врачи во многих странах прописывали беременными женщинами как эффективное снотворное и успокаивающее. Однако со временем проявилось его ужасное побочное действие: вещество оказалось тератогенным (повреждающим зародыш, от греческого teratos чудовище, урод), и на свет появилась масса младенцев с врожденными уродствами. Лишь в конце 80-х годов выяснилась, что причиной несчастий был только один из энантиомеров талидомида его правовращающая форма. К сожалению, такое различие в действии лекарственных форм раньше не было известно, и талидомид был рацемической смесью обоих антиподов.
В настоящее время многие лекарственные средства выпускаются в виде оптически чистых соединений. Так, из 25 наиболее распространенных с США лекарств только шесть являются нехиральными соединениями, три это рацематы, остальные чистые энантиомеры. Последние получают тремя методами: разделением рацемических смесей, модификацией природных оптически активных соединений (к ним относятся углеводы, аминокислоты, терпены, молочная и винная кислоты и др.) и прямым синтезом. Например, известная химическая фирма Merck разработала способ производства гипотензивного препарата метилдофа, включающий самопроизвольную кристаллизацию только нужного энантиомера путем введения в раствор небольшой затравки этого изомера. Прямой синтез также требует хиральных источников, поскольку любые другие традиционные методы синтеза дают оба энантиомера в равных пропорциях рацемат. Это, кстати, одна из причин очень высокой стоимости некоторых лекарств, поскольку направленный синтез только одного из них очень сложная задача. Поэтому не удивительно, что из более 500 синтетических хиральных препаратов, выпускаемых во всем мире, примерно лишь десятая часть являются оптически чистыми. В то же время из 517 препаратов, полученных из природного сырья, только восемь это рацематы.
Необходимость в оптически чистых энантиомерах объясняется тем, часто только один из них обладает требуемым терапевтическим эффектом, тогда как второй антипод может вызвать нежелательные побочные эффекты или даже быть токсичным. Бывает и так, что каждый энантиомер обладает своим специфическим действием. Так, S()-тироксин («левотроид») это природный гормон щитовидной железы. А правовращающий R(+)-тироксин («декстроид») понижает содержание холестерина в крови. Некоторые производители придумывают для подобных случаев торговые названия-палиндромы, например, Darvon и Novrad.
Чем же объясняется различное действие энантиомеров? Человек существо хиральное. Асимметрично и его тело, и молекулы биологически активных веществ, из которых оно состоит. Молекулы хиральных лекарств, взаимодействуя с определенными хиральными центрами организма, например, ферментами, могут действовать по-разному в зависимости от того, каким именно энантиомером является лекарство. «Правильное» лекарство подходит к своему рецептору, как ключ к замку и запускает желаемую биохимическую реакцию. Действие же «неправильного» антипода можно уподобить попытке пожать правой рукой правую же руку своего гостя.
Если лекарство рацемат, то один из энантиомеров может в лучшем случае оказаться индифферентным, в худшем вызвать совершенно нежелательный эффект. Вот несколько примеров. Так, антиаритмическое средство S()-анаприлин действует в 100 раз сильнее, чем R(+)-форма! В случае верапамила оба энантиомера обладают сходным эффектом, однако его R(+)-форма обладает значительно менее сильным побочным кардиодепрессивным эффектом. Применяющийся для наркоза кетамин может у 50% пациентов вызвать побочные эффекты в виде возбуждения, бреда и т.п., причем это присуще в основном только R()-изомеру, а также рацемату.У антигельминтного препарата левамизола активен в основном в S()-изомер, тогда как его R(+)-антипод вызывает тошноту, поэтому в свое время рацемический левамизол был заменен одним из энантиомеров. Но, оказывается, экономически не всегда имеет смысл синтезировать чистые изомеры. Например, для широко применяющегося анальгетика ибупрофена под действием ферментов возможна изомеризация терапевтически неактивной R()-формы в активный S(+)-изомер, поэтому в данном случае можно использовать значительно более дешевый рацемат.
Разное биологическое действие «правых» и «левых» изомеров проявляется не только среди лекарственных средств, а во всех случаях, когда хиральное соединение взаимодействует с живыми организмами. Яркий пример аминокислота изолейцин: ее правовращающий изомер сладкий, а левовращающий горький. Другой пример. Карвон вещество с очень сильным ароматом (человеческий нос способен почувствовать его при содержании в воздухе всего 17 миллионных долей миллиграмма в литре). Карвон выделяют из тмина, в масле которого его содержится около 60%. Однако точно такое же соединение с тем же строением находится в масле кудрявой мяты там его содержание достигает 70%. Каждый согласится с тем, что запах мяты и тмина вовсе не одинаковы. Оказалось, что на самом деле карвонов два «правый» и «левый». Различие в запахе этих соединений показывает, что клетки-рецепторы в носу, ответственные за восприятие запаха, также должны быть хиральными.
Вернемся теперь к формуле, изображенной на собаке и волке. Пеницилламин (3,3-диметилцистеин) довольно простое производное аминокислоты цистеина. Это вещество применяют при острых и хронических отравлениях медью, ртутью, свинцом, другими тяжелыми металлами, так как оно обладает способностью давать прочные комплексы с ионами этих металлов; образующиеся комплексы удаляются почками. Применяют пеницилламин также при различных формах ревматоидного артрита, при системной склеродермии, в ряде других случаев. При этом применяют только S-форму препарата, так как R-изомер токсичен и может привести к слепоте.
Теория Вант-Гоффа далеко не сразу завоевала признание. Так, выдающийся немецкий химик-экспериментатор Адольф Кольбе, (его именем названо несколько органических реакций), опубликовал в мае 1877 года язвительную статью, в которой резко отрицательно отозвался о новой теории. К счастью, Кольбе оказался в явном меньшинстве, и теория Вант-Гоффа, заложившая основы современной стереохимии, завоевала общее признание, а ее создатель в 1901 стал первым лауреатом Нобелевской премии по химии.
источник

