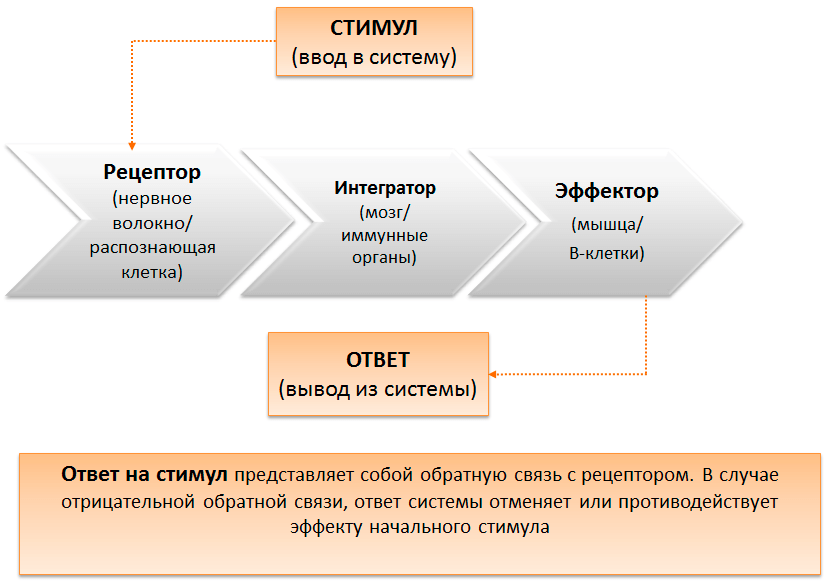
Механизмы интеграции элементов иммунной системы
Иммунная система функционирует как единое целое благодаря наличию центральных нейрогуморальных и местных факторов, регулирующих процессы пролиферации и дифференцировки клеток, упорядоченную миграцию, осуществляемую через кровь и лимфу. В эмбриональный период происходит переключение кроветворения из желточного мешка в печень и далее в костный мозг. У взрослых основным поставщиком СКК становится костный мозг, при этом в кровь мигрирует за сутки около 2% всех стволовых клеток костного мозга. При действии антигенов их число увеличивается в десятки раз. Предполагают, что процесс миграции СКК из костного мозга и их рециркуляция находятся под контролем гормонов гипофиза и надпочечников. Глюкокортикоидные гормоны коры надпочечников препятствуют избыточной миграции СКК и тем самым предохраняют их от «перерасходования».
Циркуляция лимфоцитов зависит также от специфических взаимодействий между поверхностью лимфоцита и поверхностью специализированных эндотелианых клеток, выстилающих посткапиллярные венулы с высоким эндотелием — HEV (hight endothelial venulae) во вторичных лимфоидных органах: лимфоциты временно прикрепляются к ним, а затем мигрируют через посткапиллярные венулы. Моноклональные антитела, связываясь с поверхностью лимфоцитов и подавляя их способность присоединяться к специализированным эндотелиальным клеткам в срезах тканей, а также циркулировать in vivo, помогают определить различные «homing-рецепторы» на эндотелиоцитах, от которых зависят пути миграции лимфоцитов.
Различают два типа миграции клеток иммунной системы: медленный и быстрый. Продолжительность медленной миграции измеряется неделями. Медленный тип миграции характерен для стволовых клеток и Т- и В-лимфоцитов, заселяющих периферические лимфоидные органы. Быстрый тип миграции (несколько часов) характерен для постоянно рециркулирующих долгоживущих лимфоцитов памяти. Они мигрируют из крови в периферические лимфоидные органы и из них обратно в кровь. Популяция быстро рециркулирующих лимфоцитов содержит главным образом Т-лимфоциты. Большинство медленно мигрирующих клеток относится к В-клеткам. При остром иммунном ответе происходит миграция предшественников эффекторных цитотоксических лимфоцитов и плазмоцитов через кровь и лимфу во все отделы иммунной системы и соединительную ткань, где обеспечиваются условия для иммунного ответа. Число рециркулирующих лимфоцитов в крови человека составляет около 10 10 .
Рециркулирующие лимфоциты представляют собой основную часть популяции малых лимфоцитов, большинство из которых являются долгоживущими Т-лимфоцитами; меньшее число составляют В-лимфоциты.
Рециркулирующие лимфоциты имеют оптимальную возможность к встрече с любой чужеродной мишенью, которую они сами непосредственно уничтожают, вырабатывая антитела.
Лимфоциты при помощи рецепторов осуществляют «проверку» всех тканей организма, выявляя чужеродный материал. При попадании антигена в периферические лимфоидные органы в зонах его расположения концентрируются Т-лимфоциты. В этих же зонах несколько позднее появляются В-лимфоциты. Происходит взаимодействие макрофагов, Т- и В-лимфоцитов и кооперативное распознавание антигена, приводящее к дифференцировке из В-лимфоцитов — клеток памяти и плазмоцитов, продуцирующих антитела.
Лимфоциты памяти живут в течение 20 лет и более. Считают, что приобретенное свойство памяти лимфоцитов наследуется.
Таким образом, процессы миграции и рециркуляции клеток иммунной системы обеспечивают поддержание иммунного гомеостаза.
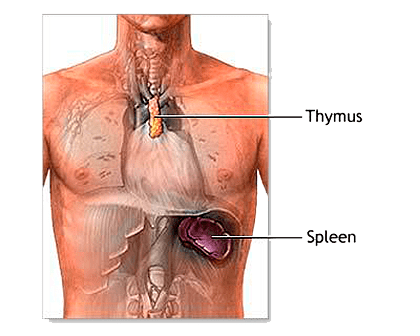
68. К системе органов кроветворения и иммунной защиты относят красный костный мозг, тимус (вилочковая железа), селезенку, лимфатические узлы, а также лимфатические узелки в составе слизистых оболочек (например, пищеварительного тракта — миндалины, лимфатические узелки кишечника, и других органов). Это совокупность органов, поддерживающих гомеостаз системы крови и иммунокомпетентных клеток.
Различают центральные и периферические органы кроветворения и иммунной защиты.
К центральным органам кроветворения и иммунной защиты у человека относятся красный костный мозг и тимус. В красном костном мозге образуются эритроциты, тромбоциты, гранулоциты и предшественники лимфоцитов. Тимус — центральный орган лимфопоэза.
В периферических кроветворных органах (селезенка, лимфатические узлы, гемолимфатические узлы) происходят размножение приносимых сюда из центральных органов Т- и В-лимфоцитов и специализация их под влиянием антигенов в эффекторные клетки, осуществляющие иммунную защиту, и клетки памяти (КП). Кроме того, здесь погибают клетки крови, завершившие свой жизненный цикл.
Органы кроветворения функционируют содружественно и обеспечивают поддержание морфологического состава крови и иммунного гомеостаза в организме. Координация и регуляция деятельности всех органов кроветворения осуществляются посредством гуморальных и нервных факторов организма, а также внутриорганных влияний, обусловленных микроокружением.
Несмотря на различия в специализации органов гемопоэза, все они имеют сходные структурно-функциональные признаки. В основе большинства их лежит ретикулярная соединительная ткань, которая образует строму органов и выполняет роль специфического микроокружения для развивающихся гемопоэтических клеток и лимфоцитов. В этих органах происходят размножение кроветворных клеток, временное депонирование крови или лимфы. Кроветворные органы благодаря наличию в них специальных фагоцитирующих и иммунокомпетентных клеток осуществляют также защитную функцию и способны очищать кровь или лимфу от инородных частиц, бактерий и остатков погибших клеток.
Дата публикования: 2014-11-03 ; Прочитано: 1022 | Нарушение авторского права страницы
studopedia.org — Студопедия.Орг — 2014-2020 год. Студопедия не является автором материалов, которые размещены. Но предоставляет возможность бесплатного использования (0.001 с) .
источник
Механизмы интеграции элементов иммунной системы
Участие тучных клеток и эозинофилов в иммунных реакциях
При первичном и особенно при повторном введении антигенов наблюдаются увеличение числа тучных клеток, их контакт с макрофагами и массовая дегрануляция. Высказывается предположение, что дегрануляция обусловлена соединением антигена с антителами (IgE), фиксированными на цитолемме. При этом выделяются содержащиеся в гранулах биологически активные вещества (гистамин, серотонин, гепарин), которые могут оказывать неспецифическое стимулирующее влияние на процессы пролиферации и дифференцировки иммунокомпетентных клеток Т- и В-лимфоцитов.
Появление в тканях избытка гистамина приводит к увеличению числа эозинофилов, которые участвуют в его разрушении (они выделяют гистаминазу). Введение в организм большинства антигенов сопровождается увеличением числа эозинофилов в тканях и регионарных лимфатических узлах. В ранней (индуктивной) фазе иммунной реакции, когда происходит «распознавание антигена», эозинофилы, как и тучные клетки, принимают участие в активизации макрофагов. В продуктивной фазе иммунитета (выработка антител) эозинофилы выполняют дезинтоксикационную функцию, участвуя в фагоцитозе и разрушении комплекса антиген — антитело.
Иммунная система функционирует как единое целое благодаря наличию центральных нейрогуморальных и местных факторов, регулирующих процессы пролиферации и дифференцировки клеток, упорядоченную миграцию, осуществляемую через кровь и лимфу. В эмбриональный период происходит переключение кроветворения из желточного мешка в печень и далее в костный мозг. У взрослых основным поставщиком СКК становится костный мозг, при этом в кровь мигрирует за сутки около 2% всех стволовых клеток костного мозга. При действии антигенов их число увеличивается в десятки раз. Предполагают, что процесс миграции СКК из костного мозга и их рециркуляция находятся под контролем гормонов гипофиза и надпочечников. Глюкокортикоидные гормоны коры надпочечников препятствуют избыточной миграции СКК и тем самым предохраняют их от «перерасходования».
Циркуляция лимфоцитов зависит также от специфических взаимодействий между поверхностью лимфоцита и поверхностью специализированных эндотелианых клеток, выстилающих посткапиллярные венулы с высоким эндотелием — HEV (hight endothelial venulae) во вторичных лимфоидных органах: лимфоциты временно прикрепляются к ним, а затем мигрируют через посткапиллярные венулы. Моноклональные антитела, связываясь с поверхностью лимфоцитов и подавляя их способность присоединяться к специализированным эндотелиальным клеткам в срезах тканей, а также циркулировать in vivo, помогают определить различные «homing-рецепторы» на эндотелиоцитах, от которых зависят пути миграции лимфоцитов.
Различают два типа миграции клеток иммунной системы: медленный и быстрый. Продолжительность медленной миграции измеряется неделями. Медленный тип миграции характерен для стволовых клеток и Т- и В-лимфоцитов, заселяющих периферические лимфоидные органы. Быстрый тип миграции (несколько часов) характерен для постоянно рециркулирующих долгоживущих лимфоцитов памяти. Они мигрируют из крови в периферические лимфоидные органы и из них обратно в кровь. Популяция быстро рециркулирующих лимфоцитов содержит главным образом Т-лимфоциты. Большинство медленно мигрирующих клеток относится к В-клеткам. При остром иммунном ответе происходит миграция предшественников эффекторных цитотоксических лимфоцитов и плазмоцитов через кровь и лимфу во все отделы иммунной системы и соединительную ткань, где обеспечиваются условия для иммунного ответа. Число рециркулирующих лимфоцитов в крови человека составляет около 10 10 .
Рециркулирующие лимфоциты представляют собой основную часть популяции малых лимфоцитов, большинство из которых являются долгоживущими Т-лимфоцитами; меньшее число составляют В-лимфоциты.
Рециркулирующие лимфоциты имеют оптимальную возможность к встрече с любой чужеродной мишенью, которую они сами непосредственно уничтожают, вырабатывая антитела.
Лимфоциты при помощи рецепторов осуществляют «проверку» всех тканей организма, выявляя чужеродный материал. При попадании антигена в периферические лимфоидные органы в зонах его расположения концентрируются Т-лимфоциты. В этих же зонах несколько позднее появляются В-лимфоциты. Происходит взаимодействие макрофагов, Т- и В-лимфоцитов и кооперативное распознавание антигена, приводящее к дифференцировке из В-лимфоцитов — клеток памяти и плазмоцитов, продуцирующих антитела.
Лимфоциты памяти живут в течение 20 лет и более. Считают, что приобретенное свойство памяти лимфоцитов наследуется.
Таким образом, процессы миграции и рециркуляции клеток иммунной системы обеспечивают поддержание иммунного гомеостаза.
68. К системе органов кроветворения и иммунной защиты относят красный костный мозг, тимус (вилочковая железа), селезенку, лимфатические узлы, а также лимфатические узелки в составе слизистых оболочек (например, пищеварительного тракта — миндалины, лимфатические узелки кишечника, и других органов). Это совокупность органов, поддерживающих гомеостаз системы крови и иммунокомпетентных клеток.
Различают центральные и периферические органы кроветворения и иммунной защиты.
К центральным органам кроветворения и иммунной защиты у человека относятся красный костный мозг и тимус. В красном костном мозге образуются эритроциты, тромбоциты, гранулоциты и предшественники лимфоцитов. Тимус — центральный орган лимфопоэза.
В периферических кроветворных органах (селезенка, лимфатические узлы, гемолимфатические узлы) происходят размножение приносимых сюда из центральных органов Т- и В-лимфоцитов и специализация их под влиянием антигенов в эффекторные клетки, осуществляющие иммунную защиту, и клетки памяти (КП). Кроме того, здесь погибают клетки крови, завершившие свой жизненный цикл.
Органы кроветворения функционируют содружественно и обеспечивают поддержание морфологического состава крови и иммунного гомеостаза в организме. Координация и регуляция деятельности всех органов кроветворения осуществляются посредством гуморальных и нервных факторов организма, а также внутриорганных влияний, обусловленных микроокружением.
Несмотря на различия в специализации органов гемопоэза, все они имеют сходные структурно-функциональные признаки. В основе большинства их лежит ретикулярная соединительная ткань, которая образует строму органов и выполняет роль специфического микроокружения для развивающихся гемопоэтических клеток и лимфоцитов. В этих органах происходят размножение кроветворных клеток, временное депонирование крови или лимфы. Кроветворные органы благодаря наличию в них специальных фагоцитирующих и иммунокомпетентных клеток осуществляют также защитную функцию и способны очищать кровь или лимфу от инородных частиц, бактерий и остатков погибших клеток.
Дата добавления: 2015-04-30 ; Просмотров: 567 ; Нарушение авторских прав? ;
Нам важно ваше мнение! Был ли полезен опубликованный материал? Да | Нет
источник
Взаимодействие нервной и иммунной систем: предпосылки новой терапии
«Дао гомеостаза»: единство нервной и иммунной систем
Автор
Редакторы
Статья на конкурс «био/мол/текст»: Иммунная и нервная системы в клинических и фундаментальных исследованиях долгое время рассматривались по-отдельности, и как следствие появилось множество методов коррекции нарушений либо одной, либо другой системы, но никогда их обеих. На самом деле, можно ли вылечить депрессию, применяя иммуномодуляторы? Можно ли скорректировать нарушения иммунитета, принимая антидепрессанты? А что будет, если их применять вместе — не является ли это ключом к решению проблемы хронических и устойчивых заболеваний? Факты, накопленные к настоящему моменту, отчасти позволяют дать утвердительные ответы на эти вопросы, но многое пока остаётся неясным.
Конкурс «био/мол/текст»-2013
Эта статья представлена на конкурс научно-популярных работ «био/мол/текст»-2013 в номинации «Своя работа».
Спонсор конкурса — дальновидная компания Thermo Fisher Scientific. Спонсор приза зрительских симпатий — фирма Helicon.
Дао гомеостаза
В последнее время накопилось немало исследований, показывающих, что нервная, иммунная и эндокринная системы работают не полностью автономно, а в тесной кооперации, формируя единую систему реагирования на изменения окружающей среды. Пониманию важной роли взаимодействия между этими системами организма поспособствовало переосмысление идеи гомеостатического равновесия (рис. 1), которая была предложена в 1932-м году Уолтером Кенноном в книге «Мудрость тела». Согласно ей все физиологические процессы в теле работают скоординированно. И таким образом, если происходят изменения в одной из составляющих данного равновесия, то это неизбежно должно отразиться и на другой. Как оказалось, нервная и иммунная системы, взаимодействуя друг с другом, являются механизмом, поддерживающим гомеостаз в организме человека, нарушение которого приводит к заболеванию [1], [2]. В связи с этим перед клиницистами и исследователями встали новые вопросы, касающиеся поиска механизмов неврологических заболеваний и методов их лечения. В последние годы этот поиск был связан с клиническими исследованиями иммунологических препаратов. Успехи не заставили себя ждать. Ведь, как оказалось, именно нервная и иммунная системы, взаимодействуя между собой, формируют функциональный «буфер», приспосабливающий организм к изменениям окружающей среды.
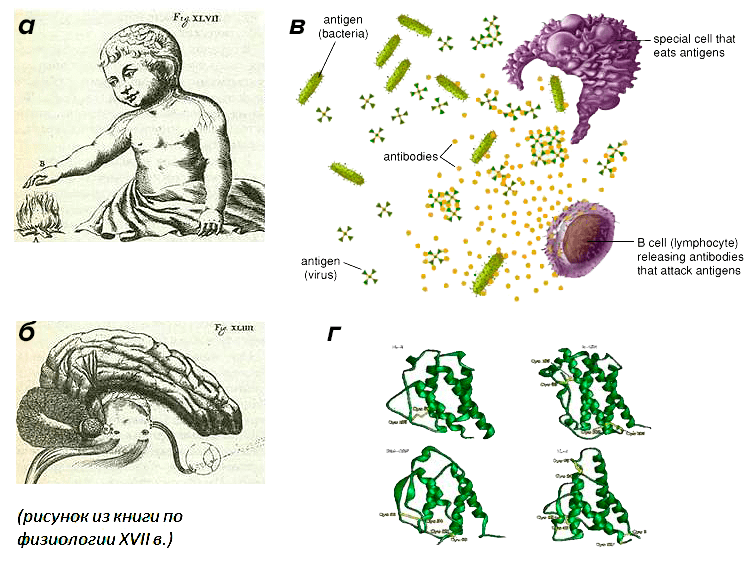
Рисунок 1. Гомеостáз (др.-греч. ομοιος — подобный, одинаковый + στασις — стояние, неподвижность) — это способность организма поддерживать функционально значимые переменные в пределах, обеспечивающих его оптимальную жизнедеятельность. Регуляторные механизмы, поддерживающие физиологическое состояние или свойства клеток, органов и систем целостного организма на уровне, соответствующем его текущим потребностям, называются гомеостатическими. Малая медицинская энциклопедия. — М.: Медицинская энциклопедия. 1991–1996 гг.
Сходства больше, чем различия?
Давно было отмечено, что нервная и иммунная системы имеют некоторые общие черты в принципах функционирования (рис. 2), а именно:
- только эти системы обладают способностью к «узнаванию объектов» (в случае иммунной системы это распознавание «своего и чужого» посредством специальных рецепторов, в случае нервной — распознавание внешних и внутренних стимулов, преобразующихся в нервный сигнал также благодаря специальным рецепторам);
- обе эти системы обладают памятью (иммунологическая память , которая позволяет В-клеткам памяти запоминать антигены, с которыми встретился организм, и нейрональная память, которая также способна хранить следы воздействия внешних стимулов, благодаря свойству пластичности нервных клеток);
- эти системы способны выделять химические сигналы, которые регулируют поведение отдельных клеток (цитокины и медиаторы соответственно), а также взаимодействуют на уровне непосредственных контактов (взаимодействие рецептор–лиганд в случае иммунных клеток и щелевые контакты в случае нервных клеток).
Подробнее о концепции иммунологической памяти мы рассказывали в статье «Иммунологическая Нобелевская премия (2011)» [3].
Рисунок 2. Параллели в работе нервной и иммунной систем. а — осязание; б — зрение; в — распознавание антигена; г — цитокины. Нервная система воспринимает сенсорные сигналы (физические, химические, эмоциональные), а иммунная — чужеродные субстанции (антигены, опухолевые клетки), которые не могут распознать нервная и эндокринная системы. При этом иммунная система использует эндокрин-подобные механизмы взаимодействия с нервной системой, а именно химические сигналы, где медиаторами служат цитокины.
Позднее было обнаружено, что существует прямой «диалог» между нервной и иммунной системами, и осуществляется он при помощи химических сигналов (рис. 3). Клетки иммунной системы — лимфоциты — имеют рецепторы для ряда нейромедиаторов, таких как ацетилхолин, дофамин, энкефалины и эндорфины [2]. В центральной нервной системе (ЦНС) нет иммунных клеток, характерных для периферии, но есть своя внутренняя «служба иммунной безопасности», представленная глиальными клетками, которые способны производить различные цитокины. Впрочем, активированные Т-лимфоциты все же могут преодолевать гематоэнцефалический барьер. Таким образом в ЦНС обеспечивается иммунологический надзор.
Рисунок 3. Цитокины и нейромедиаторы. Слева: Цитокины — группа гормоноподобных белков и пептидов — синтезируются и секретируются клетками иммунной системы и другими типами клеток. Цитокины принимают участие в регуляции роста, дифференцировки и продолжительности жизни клеток, а также в управлении апоптозом. Справа: Нейромедиаторы — физиологически активные вещества, вырабатываемые нервными клетками. С помощью нейромедиаторов нервные импульсы передаются от одного нервного волокна другому волокну или другим клеткам через пространство, разделяющее мембраны контактирующих клеток; это пространство, называемое синаптической щелью, является составной частью синапса.
Список медиаторов, участвующих в диалоге нервной и иммунной систем (назовем его «лексикон»), продолжает расширяться. Так, первоначально в этот «лексикон» вошли некоторые классические медиаторы [5], а позднее была открыта иммуномодулирующая функция гормонов и опиоидных пептидов [6]. В итоге «лексикон» стал выглядеть следующим образом:
| Гормональные пептиды | Классические медиаторы | Эндогенные опиоиды |
|---|---|---|
|
|
|
Лавина научных открытий
После прохождения первого рубежа исследований данные о тесной взаимосвязи нервной и иммунной систем стали появляться регулярно. Было установлено, что иммунная система способна отвечать на активность клеток в ряде мозговых структур (рис. 4), таких как гипоталамус, гипофиз, гиппокамп, миндалина, вентральное поле покрышки и др., а также чувствительна к изменениям в нейрохимических системах мозга — дофаминергической, серотонинергической и др. [7].
Рисунок 4. Ключевым звеном центрального аппарата нервной регуляции функций иммунной системы является гипоталамус. Он связан со всеми звеньями центрального аппарата нервной регуляции и дает начало сложному эфферентному пути передачи центральных нейрорегуляторных влияний на иммунокомпетентные клетки, которые обладают соответствующими рецепторами к нейротрансмиттерам, нейропептидам, а также к гормонам эндокринных желёз.
Были открыты иммуномодулирующие свойства нейропептидов, что позволило существенно дополнить представления о механизмах передачи сигналов от нервной системы к иммунной. На иммунокомпетентных клетках обнаружены рецепторы ко многим известным нейропептидам, что доказывает их участие в реализации эфферентного звена нейроиммунного взаимодействия (рис. 1). Выявлены конкретные медиаторы, с помощью которых реализуется взаимосвязь между иммунокомпетентными и нервными клетками. Так, была открыта продукция опиоидных пептидов иммунокомпетентными клетками и доказана возможность действия медиаторов иммунитета на нервные клетки.
В то же время долго оставался неясным вопрос о механизмах обратной связи от иммунной системы к нервной.
Недостающее звено коммуникации
Рисунок 5. Тимус (вилочковая, или зобная, железа) — эндокринная железа, играющая важнейшую роль в формировании иммунитета. Она стимулирует развитие Т-клеток («тимусных») как в собственной ткани, так и в лимфоидной ткани других частей тела. Т-клетки атакуют попавшие в организм чужеродные вещества, осуществляют контроль над выработкой антител против болезнетворных агентов, влияют на другие защитные реакции организма. Тимус имеется у всех позвоночных животных, но его форма и местоположение могут различаться. У человека тимус состоит из двух долей, расположенных в верхней части грудной клетки сразу за грудиной.
Наконец, в 80-е годы была обнаружена продукция ряда гормонов и опиоидных пептидов иммунокомпетентными клетками и доказана возможность действия медиаторов иммунитета на нервные клетки [2]. Группа опиоидных пептидов была впервые обнаружена среди миелопептидов; в костном мозге выявлен предшественник эндорфинов — проопиомеланокортин.
Опиоидные пептиды и их предшественник были затем найдены и в вилочковой железе (тимусе) — рисунок 5. Принципиально важными стали также работы по изучению нейротропной активности цитокинов, которые, как оказалось, обладают способностью регулировать функции структур ЦНС, включая гипоталамус (центр гормональной регуляции!) и гиппокамп (ключевая структура процессов памяти), и влиять на состояние основных нейромедиаторных систем (норадреналина, серотонина и дофамина). Оказалось, что стресс и эмоциональное напряжение приводят к гомеостатическим сдвигам в иммунной и нейроэндокринной системах [8].
В преддверии новых открытий
Пептиды, составляющие «лексикон» нейроиммунного взаимодействия, имеют общие для обеих систем рецепторы. Так, иммунокомпетентные клетки могут синтезировать нейропептиды и отвечать на большинство, если не на все, соединения этой группы. Клетки нервной системы производят некоторые лимфокины и монокины и отвечают на них. Это позволяет считать, что указанные системы имеют и используют, по сути, одинаковый набор сигнальных молекул для внутрисистемной и межсистемной связи. Также за последние двадцать лет значительно увеличивается объем данных, говорящих о взаимосвязи между психическим состоянием и состоянием иммунной системы [2].
Все это в свою очередь привело исследователей к предположению о том, что ряд иммунных расстройств может быть обусловлен нарушением работы в структурах нервной системы и наоборот. Все эти предположения еще предстояло проверить на практике. И одной из наиболее строгих проверок должны были стать испытания, полученные в клиниках. Особый интерес представлял анализ психотропного эффекта препаратов, обладающих способностью модулировать иммунный ответ (рис. 6).
Рисунок 6. Цитокины влияют на выделение и обмен норадреналина и серотонина в головном мозге, в особенности в гипоталамусе и гиппокампе, оказывая как стимулирующее, так и тормозящее воздействия на основные медиаторные системы, приводя, в конечном итоге, к модуляции эмоционального состояния и процессов памяти, влияя на мотивацию поведения.
От теории к практике: новые подходы к эффективной терапии и диагностике
Интерес к проблеме повторно возник в связи с клиническими исследованиями. Первоначально в экспериментальных работах было замечено, что изменение поведения у лабораторных животных приводит к изменению параметров иммунной системы [2]. После чего, в последние десятилетия, тема нервно-иммунных взаимодействий перестала быть исключительно теоретической и нашла свое клиническое применение, вначале в соматической и неврологической практике, а затем и в психиатрии. Появились новые возможности диагностики психических расстройств на основе объективных данных и кардинально новые методы оценки эффективности терапии, в том числе и психофармакотерапии. При этом особое внимание уделяется изучению взаимодействий иммунной, нервной и эндокринной систем при стрессовых воздействиях, при тревожных расстройствах и депрессии [2].
Доклинические оценки монотерапии иммуномодуляторами (а именно, деринатом и тактивином) были проведены автором данной статьи и коллективом лаборатории эволюции механизмов обучения и памяти на кафедре физиологии высшей нервной деятельности в МГУ им. М.В. Ломоносова. В нашей работе оценивалось влияние иммуномодуляторов на коррекцию нарушений, вызванных хронической алкоголизацией [9], [10], острым и хроническим стрессом [11–13], а также на восстановление нормальных когнитивных функций (а именно, обучения и памяти), сниженных после воздействия повреждающих факторов [14]. По результатам работы были сделаны выводы о том, что данные иммуномодуляторы сами по себе способны оказывать корректирующее и протекторное действие на когнитивные функции. В нашей работе оценивалось изменение уровня обучения и памяти в разных условиях — как в норме, так и при искусственно созданной патологии, вызванной действием таких факторов как стресс и хроническая алкоголизация. Нами показано, что препарат пептидов тимуса проявляет ноотропный эффект (его сравнивали с классическим ноотропом — пирацетамом), что сказывается на темпах обучения. Также ему свойственен анксиолитический и общий протекторный эффект, что позволило животным эффективно обучаться и быстро адаптироваться в условиях давления стресса и токсичного действия алкоголя. Отдельно оценивалась способность иммуномодуляторов повышать устойчивость организма к стрессу как таковому — физическому (удары током), эмоциональному (резкое изменение условий опыта), острому (кратковременная иммобилизация), хроническому (долговременная иммобилизация). Нами получены данные о том, что иммуномодулятор тактивин оказывает эффективное стресс-протекторное действие, которое снижает пагубные последствия жесткого стресса. (У людей, как известно, стресс может явиться причиной большого ряда заболеваний, в числе которых инсульты, инфаркты, снижение иммунитета, депрессия и прочие.) При этом заметно улучшались показатели физического состояния животных, подвергшихся стрессу [13].
Данные, полученные в клинических и доклинических исследованиях, обосновывают возможность разрабатывать новые терапевтические подходы при диагностике и лечении психических заболеваний. Для психофармакологии поиск новых безопасных средств или способов снизить побочный эффект терапии особенно важен, т.к. на сегодняшний день большинство психотропных препаратов обладают выраженными побочными эффектами (например, метадоновая терапия героиновых наркоманов), либо недостаточно эффективны (хронические формы депрессии и шизофрения).
О депрессии и разновидностях антидепрессантов мы уже рассказывали в статье «Краткая история антидепрессантов» [15].
Расширенная диагностика
К настоящему времени исследованию иммунологических нарушений при тревожных и тревожно-депрессивных расстройствах посвящено достаточно большое число работ [16–18]. Для тревожных расстройств в настоящее время установлено, что при их развитии происходит активация Т-лимфоцитов, которые являются одними из основных источников и регуляторов секреции и продукции цитокинов [17].
Для ряда психических расстройств отмечалась связь между наличием и характером психопатологической симптоматики и уровнями интерферонов α и γ (то есть в патологический процесс также вовлекается иммунная система). Эти данные получены для таких заболеваний, как шизофрения, аутизм, синдром нарушенного внимания, депрессивные расстройства, навязчивые расстройства, рассеянный склероз, системная красная волчанка, ревматоидный артрит, что в свою очередь оправдывает применение иммуномодуляторов в клинике психических расстройств (рис. 7).
Рисунок 7. Иммуномодуляторы — это лекарственные препараты, восстанавливающие при применении в терапевтических дозах функции иммунной системы (эффективную иммунную защиту). В группу иммуномодуляторов выделяют препараты животного, микробного, дрожжевого и синтетического происхождения, обладающие специфической способностью стимулировать иммунные процессы и активировать иммунокомпетентные клетки (Т- и В-лимфоциты) и дополнительные факторы иммунитета (макрофаги).
Особенно интересными эти данные выглядят в свете того, что разные классы нейролептиков и антидепрессантов [15], применяющихся в клинике, обладают иммуномодулирующей активностью и способностью влиять на цитокиновую систему [18].
Новые методы лечения
С середины 1970-х годов в терапии психических расстройств применяются иммуномодуляторы и другие иммунотропные препараты. Одной из причин применения иммунотропных препаратов при психических расстройствах считается терапевтическая резистентность больных, в развитии которой важную роль играют иммунные нарушения.
Иммуннотропные препараты нормализуют иммунологические показатели в случае их отклонения от нормы в ту или иную сторону, не вызывая критических нарушений. В настоящее время существует успешная история применения иммунотропных препаратов и интерферонов в комплексной терапии. Примеры приведены в приложении в конце статьи.
Единичные исследования эффективности иммуномодуляторов в составе монотерапии (т.е. без использования традиционных для данных случаев психотропных средств) проводились при лечении шизофрении, терапии навязчивых состояний, нервной анорексии и других заболеваний ЦНС, однако в настоящее время данных для оценки эффективности такой терапии недостаточно. Таким образом, перспективы применения иммуномодулирующих пептидов в качестве монотерапии на новом поле, а именно в клинике психических расстройств и состояний зависимости (наркоманий), а также появление новых терапевтических комбинаций и диагностических методов — это перспективная задача будущих исследований. Ее успешное решение должно привести к появлению нового типа лекарств и новых методов терапии, воздействующих не на одно (в отдельности), а сразу на несколько ключевых звеньев гомеостаза. Предположительно, это позволит найти новые и более безопасные методы лечения ряда заболеваний, которые на настоящий день не имеют эффективного лечения, например, шизофрении, героиновой наркомании и алкоголизма.
Примеры использования иммуномодуляторов в клинике психопатологий
В клинических исследованиях при включении в традиционное лечение иммуномодуляторов наблюдались благоприятные эффекты, такие как снижение клинической симптоматики, снижение побочных эффектов традиционного лечения, преодоление резистивности, более стойкий и быстрый прогресс лечения. Примеры группа пациентов, успешно принимавших иммуномодуляторы в комплексной терапии:
Тактивин больные наркоманией и алкоголизмом [20]. Миелопид больные со смешанным тревожно-депрессивным расстройством; редукция психопатологической симптоматики наступает быстрее; значительно снижает риск возникновения нежелательных побочных эффектов психофармакотерапии и уменьшает их интенсивность [21]. Галавит больные с астеническим расстройством; оказывает более выраженное воздействие в сравнении с монотерапией ноотропами [22]. Ликопид больные с генерализованным тревожным расстройством; частота и степень выраженности соматических и вегетативных симптомов снижалась в сравнении с монотерапией психотропными препаратами [23]. Пропротен купирует основные соматовегетативные и психопатологические нарушения и устраняет эмоциональное напряжение у больных при алкогольном абстинентном синдроме; стресспротектор, анксиолитик [24]. Интерферон-β лечение рассеянного склероза [25]. Реаферон экспериментальный нейротоксический паркинсонизм, профилактическое введение реаферона предупреждает развитие паркинсонизма [17]. Тимусные пептиды эффективны для коррекции психоневрологического статуса больных шизофренией и больных психогенной депрессией [26]. Копаксон используется в терапии при рассеянном склерозе [25]. Левамизол снижает симптоматику приступообразной и непрерывно прогрессирующей шизофрении и других, в том числе резистентных, форм этого заболевания [27]. Бромантан и кемактан предупреждают развитие экспериментальной трифазиновой каталепсии; приводит к повышению умственной и физической работоспособности, физической выносливости, также при этом происходит коррекция иммунологического статуса [17].
источник